Равновесная композиция: Муниципальное бюджетное учреждение дополнительного образования «Учебный центр»
- Страница не найдена — Региональный модельный центр дополнительного образования детей Рязанской области
- Композиция кадра — Блог 3ddd.ru
- Что есть композиция в фотографии?
- Композиция – как она есть. Силовые линии и равновесие – Всё самое интересное!
- Основы композиции в конструктивных искусствах. Гармония, контраст и эмоциональная выразительность плоскостной композиции
- 1. Презентация по изобразительному искусству на тему: «Основы композиции в конструктивных искусствах. Гармония, контраст и
- 2. элементы композиции
- 3. Все прямоугольные элементы композиции следует вырезать из черной или белой бумаги (в зависимости от выбранного фона). Прежде
- 4. Создать конфликт между белым полем и черным пятном. Сюжет, если хотите — интрига, конструктивной композиции как раз и состоит
- 5. ПРАКТИЧЕСКАЯ РАБОТА
- 6. Упражнение 2.
- 7.
- 8. Асимметрия
- 9. Если симметричная равновесная форма воспринимается легко и сразу, то асимметричная динамичная читается постепенно.
- 10. Питер Корнелис Мондриан — художник-абстракционист,
- 11. Упражнение 3. Симметрия. Белая плоскость уже задана. Вырезаем несколько черных или цветных прямоугольников и выполняем
- 12. Ритм
- 13. Контрасты являются воздействующей силой композиции и определяют ее выразительность. Контраст — это резко выраженная
- 14. Упражнение 4. Ритм. Выполним ритмическую композицию, используя линии и прямоугольники , круги и точки.
- 15. Статичная фронтальная композиция
- КОМПОЗИЦИЯ. ПОИСК ГАРМОНИИ — Фокус на объекте — Приемы кино — Приемы и ходы
- Абстрактная композиция | Арт-Гряда
- — обзор
- 0 вязкость
- Состав равновесной смеси
- Глава 9 Химическое равновесие
- РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ C / H ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ (Технический отчет)
- (PDF) Расчет химического равновесного состава воздуха до 30000K
- Факторы, влияющие на равновесие
Страница не найдена — Региональный модельный центр дополнительного образования детей Рязанской области
Аннотация по внедрению инновационной практики «Приобщение детей к книге и чтению через игру и элементы театрализации (театр теней)» по дополнительной общеобразовательной общеразвивающей программе «Игралочка»
в ОГБУДО «Центр эстетического воспитания детей»
В настоящее время педагоги и родители обращают внимание на то, что многие дети младшего школьного возраста неохотно читают и слушают чтение, а самой любимой игрушкой ребёнка зачастую оказываются планшет, телефон, компьютер.
Как приобщить ребёнка к книге, сделать чтение не только школьной необходимостью, но и удовольствием? Над этим вопросом бьются многие поколения педагогов и родителей. Единственно верного ответа, к сожалению, пока никто не нашёл, но любая игра, связанная с чтением, в которую будет вовлечён ребёнок, заставляет его обратиться к книге.
Ведущая педагогическая идея Любая игра, связанная с чтением, в которую будет вовлечён ребёнок, заставляет его обратиться к книге. Процесс обучения необходимо построить таким образом, чтобы игра и чтение, помогая, дополняли друг друга. Это сформирует желание читать, сделает чтение необходимым инструментом в другой, интересной для ребёнка деятельности.
Теоретическая основа: Занятия по дополнительной общеобразовательной общеразвивающей программе «Игралочка» ( автор Звездочкина И.И.) позволяют добавить в новый сложный этап в жизни ребёнка (начало обучения в школе) то, к чему он привык с рождения — игру. Кроме того, именно знания, полученные через игру, оказываются прочнее, помогают внести разнообразие в учебную деятельность.
Содержание курса представляют собой изучение игр, игрушек и детских забав в русской и мировой литературе. Для детей подобраны игры, связанные с литературой, рассматриваются произведения (их отрывки), где рассказывается об играх, игрушках и забавах для детей разных стран, народов и времён.
Обращение к литературному материалу позволяет поговорить с ребятами о книгах, их авторах и героях, рассказать о литературном произведении и изображённых в нём событиях как о чём-то близком к современной жизни детей, что, в свою очередь, воспитывает интерес к чтению и книге. Использование на занятиях различных игровых стихов, считалочек, закличек и т.п. позволяет тренировать память и навыки выразительного чтения.
Каждое занятие имеет логическую завершённость. Его можно провести отдельно (на внешкольном мероприятии, в лагере, в группе продлённого дня, на массовом празднике и т.п.) или выделить из программы необходимый модуль, например по русским народным сказкам.
Для занятий не требуется сложного технического оборудования: необходимо помещение, где можно провести игры малой и средней подвижности, тексты произведений, элементарный инвентарь (бумага, карандаши, мячи, скакалки и т.п.).
Результативность работы рассматривалась исходя из двух направлений: расширение читательского опыта учащихся, умения работать с текстом и развитие коммуникативных способностей детей. Результаты диагностики показали, что дети научились искать нужную информацию в тексте, пересказывать отрывок произведения, работать в команде, описывать литературного героя, умению организовать игру самостоятельно.
Адресная направленность Программа рассчитана на детей 7-10 лет. Объединения могут быть созданы на базе группы продлённого дня, целого класса, лагеря дневного пребывания и т.д. Программа прошла апробацию и внедрена в пяти творческих объединениях на базе трёх средних школ города Рязани: МБОУ «Школа №44», МБОУ «Школа №64», МБОУ «Школа №19 (25)».
Более подробно познакомиться с методическим материалом внедрения данной практики можно на сайте ОГБУДО ЦЭВД https://www.estet-ryazan.ru в разделе «Образование».
Композиция кадра — Блог 3ddd.ru
В данной статье я проведу авторский композиционный анализ сюжета «Девушка из Дании» фотограф Энни Лейбовиц. Во время подготовки статьи я хотел формально отписаться о различных вариантах применения золотого сечения, динамической симметрии, но в итоге я проведу композиционный анализ одной работы. Почему я назвал этот анализ «авторским», да потому, что я не уверен в том что мои мысли совпадут с мнением создателя фотографии. Я всегда усмехаюсь, когда искусствоведы, при анализе произведения искусства начинают свое повествование со слов — «автор хотел сказать», да откуда такая уверенность в том что хотел сказать автор…?
Во время подготовки статьи я хотел формально отписаться о различных вариантах применения золотого сечения, динамической симметрии, но в итоге я проведу композиционный анализ одной работы. Почему я назвал этот анализ «авторским», да потому, что я не уверен в том что мои мысли совпадут с мнением создателя фотографии. Я всегда усмехаюсь, когда искусствоведы, при анализе произведения искусства начинают свое повествование со слов — «автор хотел сказать», да откуда такая уверенность в том что хотел сказать автор…?
Стандартный подход к композиционному анализу, а именно правило третей и золотое сечение не дали особого понимания композиционного замысла. Так называемые «горячие точки» не дают никакой информации, за которую можно зацепиться. Да герои располагаются в «правильных» местах, ну и что?
Золотое сечение
Правило третей
Конечно историю можно притянуть за «уши» — «натурщик» позирует художнику, если выделить четверти. Где малая четверть фиксирует завязку сюжета — излишне сосредоточенный взгляд позирующего, так обычно бывает, когда натурщик позирует в первый раз. Ну и большая четверть непосредственно композиционное раскрытие сюжета, где фиксируется процесс работы самого художника. Как-то слабовато…
Очевидно что надо искать другой подход. Тогда я решил поиграть с диагональными взаимодействиями и поискать динамическую симметрию в композиции.Поскольку «европейская цивилизация» приучена к чтению слева на право, то мы, по привычке, рассматриваем художественные произведения слева на право. Свои диагонали я запустил так же от левых углов. И тут уже стало что-то «вырисовываться». Второй «отскок» повторил линию движения кисти во рту художника и мне показалось это уже не случайным.
Но теперь горизонтальные линии золотого сечения никак не взаимодействуют с диагоналями и я решил их немного раздвинуть до взаимного пересечения. Это привело к смещению зрительных центров по вертикали и одна из них попала точно в сердце «натурщика», а вторая пошла по краю подиума. Совпадение такого уровня — кисть, подиум, сердце, это уже не случайность.
Совпадение такого уровня — кисть, подиум, сердце, это уже не случайность.
Композиция по горизонтали разделилась на три равных части. Получилось гибридное решение — горизонтали выстроились согласно правила третей, а вертикали согласно золотого сечения, что подтверждает тезис — правила придуманы что бы их нарушать.
Золотое сечение, диагональный анализ
Дальнейшая диагональная разбивка и корректировка линий золотого сечения, привела меня к следующей композиционной схеме.
Золотое сечение, диагональный анализ
Ну а дальше все выстроилось в четкую симметричную систему из ромбов, прямоугольников и треугольников. Во всех комбинациях композиция стала равновесной и стала четко читаться динамическая симметрия.
Золотое сечение, диагональный анализ
Анализ прямоугольной сетки и выделение основных сюжетных прямоугольников, задают композиции четкий ритм, положение фигур в кадре становятся более обоснованными.
Золотое сечение, прямоугольная разбивка
Золотое сечение, прямоугольная разбивка
Тональный анализ, так же подчеркивает четкую динамическую симметрию, к которой прибегнул автор фотографии.
Золотое сечение, тональный анализ
Золотое сечение, тональный анализ
Не менее интересно работа начинает читаться при гексагональной сетке.
Золотое сечение, гексагональная сетка
Первичный сюжет. Первый гексагон это завязка. Второй гексагон это композиционное развитие сюжета, объясняющее что происходит вообще.
А сейчас пойдет искусствоведческий бред
Философское раскрытие сюжета заключено в других частях — две половины гексагона, расположенные в нижней и верхней частях работы.Натурщик сидит на подиуме и он вот вот возвысился на простой жизнью и станет частью чего-то большего. Свидетельства его «приземленной» натуры — ботинки и таз для ног.
Голова художника наоборот, как у всех творческих людей (о боже… какое клише) — витает в облаках, взгляд опущен и сосредоточен на творческом процессе.
Данный подтекст — возвышенного и приземленного, поддержан так же и в прямоугольной разбивке изображения.
Но при чем здесь собака? Да ни причем. Иногда банан, это просто банан, а собака просто визуально уравновешивает композиционное решение основного сюжета. Вместо собаки могло быть что-то другое, но этот предмет находился бы в том же самом месте и был бы светлым по тону, но искусствоведы те ещё выдумщики и думаю они смогут дать сюжетное обоснование наличия собаки в композиции
Что могу посоветовать начинающим для изучения композиции?
Узнать все о Золотом сечении
Узнать все о Формальной композиции (Пропедевтика. Основы композиции)
Узнать все о Динамической симметрии
Узнать все о базовых принципах Гештальтпсихологии, ту часть где изучаются процессы психологии восприятия.
Далее уже можно пробовать анализировать работы, которые вас «цепляют» и применять результаты анализа в своей практике. В текучке конечно не встроить сложную композицию, на это просто нет времени, но никто не мешает «запилить» один ракурс по всем правилам в свободное от работы время.
Для текучки
Композицию можно построить так, чтобы главный объект в изображении находился в пересечении хотя бы с одной из горячих точек (зрительные центры).
Можно работать с «четвертями», взяв одну из точек за композиционный центр, выстраивая композицию по четвертям
Для удобства можно воспользоваться вот этим скриптом, который наносит сетку золотого сечения (и другие фигуры) прямо во вьюпорте 3ds max. На стриме «Камера и композиция кадра», при помощи этого скрипта, я провожу анализ работ известных CG студий и CG художников (MIR, Bertrand Benoit), в работах которых отчетливо прослеживается использование правил золотого сечения. Так же делюсь своими опытом в выборе и установке ракурсов виртуальной камеры.
USHAKOV | CG CHANNEL
Что есть композиция в фотографии?
О композиции в искусстве фотографии уже много было сказано и написано разными авторами.
Фотографическая композиция очень многое позаимствовала у живописи. А законы композиции в живописи начали формироваться, и это можно сказать смело, больше нескольких тысяч лет назад. Но зачастую сами же художники эти каноны и нарушали! Их картины – тому подтверждение. Об этом они писали в различных своих записках. Что интересно, законы композиции на плоскости формулировали в основном люди, у которых технический образ мышления. Они просто находили в различных произведениях некоторые схожие приёмы и формулировали их словесно применимо ко всем другим изображениям – фотографическим или живописным, неважно.
Так давайте, наконец, решим: как она, композиция, работает в фотографии и работает ли вообще. Что такое композиция? Редко кто сможет дать этому понятию четкое определение. Но в общих чертах можно сказать, что композиция – это правильное и гармоничное расположение объектов на плоскости фотографического снимка. Некоторые включают в это определение еще и изображение визуальных эффектов.
Специалисты Санкт-Петербургского Государственного университета кино и телевидения провели большую исследовательскую работу по изучению законов композиции, причем, как мнимых, так и реальных. Для этой работы точкой отсчета ученые взяли механизмы физиологии зрения человека и механизмы психологии восприятия человеком визуальной информации, основой которым послужили разработки лаборатории физиологии зрения Института физиологии им. И.П.Павлова РАМН. Что считать закономерностью? Все люди разные. И поэтому нельзя твердо сказать, что все одинаково воспринимают то или иное изображение. Именно поэтому ученые приняли решение считать закономерностью такую композицию, которая воспринимается одинаково двумя третями людей, которые выбирают из двух снимков, или половиной испытуемых при выборе из трех или более изображений.
Специалисты разработали несколько тестов. Для этого они из различных источников (литературы, периодики, интернет-сайтов) выписали все возможные законы композиции. После чего все эти законы были проанализированы, и некоторые из них объединены в одну закономерность. После чего ученые выписали все закономерности, которые обусловлены психологией нашего восприятия и человеческого зрения. Следующим этапом работы ученых было создание тестовых фотографий для каждой закономерности. В нескольких фотографиях в рамках одного теста менялся только один параметр. Для получения большей достоверности результата, какой именно параметр менялся, в вопросах теста не указывалось.
Исследования проходили по правилам и законам социологии, причем, и индивидуально, и коллективно. Так же использовались интернет-технологии. Испытуемым предлагалось два вида просмотра фотографий: неограниченно долгое время, и время, ограниченное коротким временным промежутком (это важно, например, при анализе просмотра рекламных плакатов, когда главная цель — мгновенно заставить зрителя обратить внимание на это изображение). А в лаборатории физиологии зрения специалисты проводили уже компьютерное измерение отобранных тестируемыми изображений при помощи специальных программ, которые имитируют механизмы человеческого зрения.
Какие же результаты получили учёные?
Специалисты пришли к выводу, что подавляющее число законов композиции, описанных в литературе, являются именно придуманными, так как они не воспринимаются большинством зрителей именно так, как того хотели бы того их авторы. Как выяснилось, дело обстоит гораздо проще, но, в то же время и сложнее, так как фотография, которая была бы понятна для восприятия большинству зрителей, имеет совсем другую идеологию, другую систему ценностей.
Основной вывод учёных таков: все законы композиции, разработанные для фотографии, обуславливаются исключительно природой человека, психологией восприятия и механизмами человеческого зрения. Всевозможные отступления от этих правил являются надуманными законами композиции и не находят своего подтверждения. Интересно, что реально работающих закономерностей довольно мало. Всего несколько. На первом этапе работы ученые нашли в литературе около шестидесяти сформулированных законов композиции, а реально действующими они признали всего треть из них. Две трети законов они посчитали либо частными случаями, либо не воспринимаемыми большинством зрителей.
Всевозможные отступления от этих правил являются надуманными законами композиции и не находят своего подтверждения. Интересно, что реально работающих закономерностей довольно мало. Всего несколько. На первом этапе работы ученые нашли в литературе около шестидесяти сформулированных законов композиции, а реально действующими они признали всего треть из них. Две трети законов они посчитали либо частными случаями, либо не воспринимаемыми большинством зрителей.
Яркий пример этому – знаменитое «золотое сечение», в фотографии именуемое «правилом одной трети». Как оказалось, что как закономерность оно в фотографии не воспринимается вообще! Санкт-петербургские исследователи утверждают, что все тесты, в которых они изучали «золотое сечение», дали до странности одинаковый результат. Хоть в тесте было три, хоть пять снимков – голоса испытуемых распределились в одинаковой пропорции. Таким образом, ни о какой закономерности восприятия тут не может быть и речи. Так что закон золотого сечения в фотографии не работает. Это доказано. А при фотосъемке нужно руководствоваться другими законами.
Ученые так же выяснили, что линию горизонта на фотографии можно располагать как угодно и где угодно. Даже можно просто поделить кадр пополам. И снимок зрителю понравится. Между прочим, линию горизонта, делящую плоскость изображения ровно напополам, можно легко найти и у классиков живописи. Например, у Айвазовского или Шишкина. Законы композиции в фотографии утверждают, что длинная вертикальная линия или линия горизонта должны быть параллельны границам изображения (аналитики называют это «пьяной вертикалью» или «пьяным горизонтом»). Но это подтвердилось только отчасти – при условии, что эту линию пересекает динамичный или просто крупный объект. В этом случае линия горизонта уравновешивает этот объект своим искривлением. И тогда он должен быть «пьяным».
В этом тесте голоса испытуемых разделились поровну.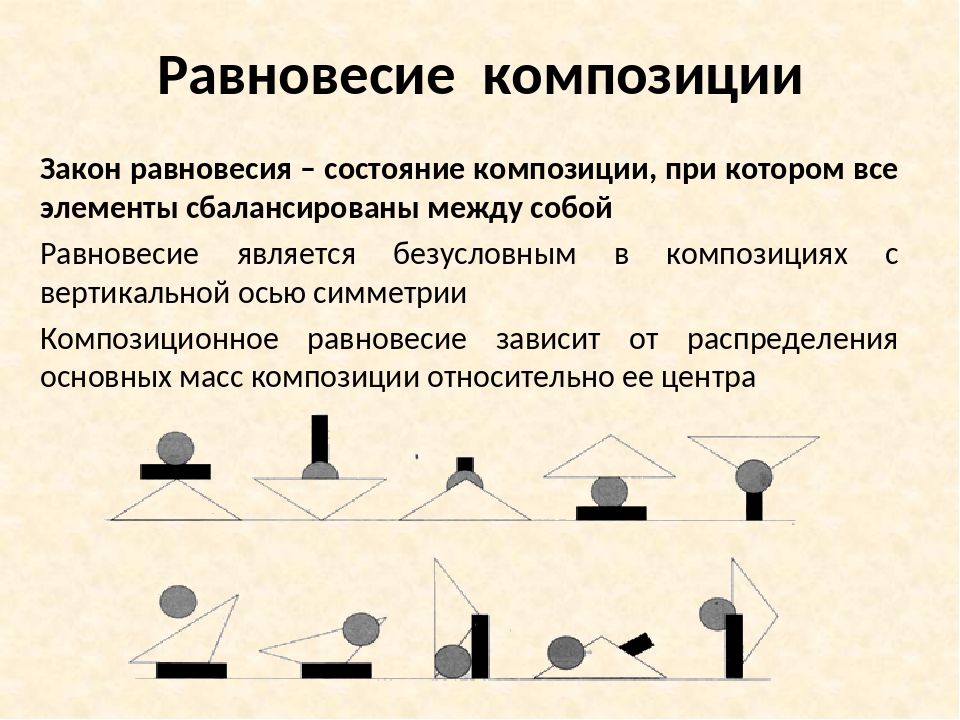 «Пьяный горизонт» воспринимают нормально. Закон о расположении в кадре конкретного крупного объекта. Большинство зрителей не видят разницы в том, в какой части снимка находится главный объект. Он может располагаться в центре, по краям, сверху или снизу… При прочих равных условиях восприятие его зрителем не изменяется. Большинство выбирают из нескольких снимков тот, на котором нет разрыва композиции.
«Пьяный горизонт» воспринимают нормально. Закон о расположении в кадре конкретного крупного объекта. Большинство зрителей не видят разницы в том, в какой части снимка находится главный объект. Он может располагаться в центре, по краям, сверху или снизу… При прочих равных условиях восприятие его зрителем не изменяется. Большинство выбирают из нескольких снимков тот, на котором нет разрыва композиции.
Не подтверждается так же и то, что если человек, изображенный на снимке в профиль, смотрит справа налево – считается, что он смотрит на задний план. А если наоборот слева направо – то на зрителя. Ученые исследовали и диагонали на снимках. Тут тоже много интересного. Зритель предпочитает определенное расположение объекта на восходящей или падающей диагонали, равновесное расположение объектов на ней независимо оттого, что изображено на снимке. Не нашло подтверждения и одинаковое восприятие восходящей и падающей диагоналей. Тут всё зависит именно от сюжета снимка.
Размытые и фон, и объект воспринимаются хуже. Далеко не всем интересен размытый объект на резком фоне. Правда, тут есть исключение – если крупный объект находится на переднем резком плане. Интересно и то, что большинство испытуемых выбирали более резкие и контрастные изображения. Фон. Основное число тестируемых предпочло однородный фон. Контрастные цвета на фоне, особенно если их более двух, воспринимаются намного хуже. Ученые изучили даже и такую, казалось бы, мелочь – количество и месторасположение бликов в глазу человека, изображенного на фотопортрете. Как выяснилось, большинству испытуемых был интересен всего лишь один округлый блик, который находится в верхней части глаза. Полное подтверждение получила новая, намного более простая, классификация фотографического освещения. Оно бывает двух видов: линейное и фактурное. Именно такая классификация соответствует природе человеческого зрения.
Так же ученые доказали, что для зрителя наименее интересен квадратный кадр. Из вертикальных и горизонтальных большинство выбирает вертикальный кадр. Ну а хоть какие-то из общепринятых законов построения изображения на плоскости подтвердились – спросите вы. Конечно! Подтвердились эффекты, которые обусловлены природой человека. То, как человек воспринимает перекрещенные и кривые линии, ритмика, ритм во всех возможных проявлениях, «эффект тоннеля», наличие смысловых центров, развивающееся движение, иррадиация, эффект продления контура, инвариантность, свойства отдельных групп объектов, эффект низкочастотной и высокочастотной фильтрации.
Из вертикальных и горизонтальных большинство выбирает вертикальный кадр. Ну а хоть какие-то из общепринятых законов построения изображения на плоскости подтвердились – спросите вы. Конечно! Подтвердились эффекты, которые обусловлены природой человека. То, как человек воспринимает перекрещенные и кривые линии, ритмика, ритм во всех возможных проявлениях, «эффект тоннеля», наличие смысловых центров, развивающееся движение, иррадиация, эффект продления контура, инвариантность, свойства отдельных групп объектов, эффект низкочастотной и высокочастотной фильтрации.
Таким образом, на основе выводов санкт-петербургских ученых, можно значительно упростить обучение фотографии, сделать его белее эффективным, так как новая теория позволяет создавать фотографические изображения, которые понятны большинству людей, а не только отражают внутренний духовный мир фотографа.
Copyright by TakeFoto.ru
Композиция – как она есть. Силовые линии и равновесие – Всё самое интересное!
Продолжаем раздел «Рукоделие» и подраздел «Рисование» статьёй Композиция – как она есть. Силовые линии и равновесие. Ранее мы более менее разобрались с изучением техники рисования, а также с подробностями техники рисования. Теперь, овладев этими навками хотя бы в общих чертах, можно переходить к композиции.
Композиция – как она есть, силовые линии и равновесие – это сложный и достаточно интересный, субЪективный вопрос, ведь взаимное гармоничное расположение предметов на рисунке – это дело вкуса каждого отдельного человека. Однако, несмотря на то, что на вкус и цвет товарища нет, существуют некоторые общие принципы композиции, пользуясь которыми, можно сделать любую кучу предметов гармоничной. По крайней мере, достаточно натренировавшись.
Композиция – это то, как относительно друг друга расположены различные предметы на рисунке или в реальности.
То, как они расположены в реальности, в данном случае не особо важно. Если вы, конечно, не занимаетесь планировкой сада камней. А вот взаимные отношения изображений объектов на рисунке… Это действительно важно. Кроме всего прочего ещё и потому, что даже если в «натуре» предметы расположены абы как, то, зная правила, на рисунке можно их расставить намного лучше, чем в жизни.
Если вы, конечно, не занимаетесь планировкой сада камней. А вот взаимные отношения изображений объектов на рисунке… Это действительно важно. Кроме всего прочего ещё и потому, что даже если в «натуре» предметы расположены абы как, то, зная правила, на рисунке можно их расставить намного лучше, чем в жизни.
Итак, первое правило – рисунок не должен касаться краёв листа, если это не предусмотрено специфической целью и дизайном. При формате А3 должно оставаться примерно по 2 см отступа от края.
Второе правило. И, собственно, основное. На рисунке должна присутствовать гармония. Другими словами, равновесие. Или же, наоборот, должно быть отсутсвие гармонии, отсутствие равновесия. Всё зависит от того, что вы хотите показать.
Что это значит?
Давайте, сравним стоящий на поверхности квадрат:
и этот же квадрат, только немного искажённый.
Какое из изображений более равновесное?
Теперь поставим большой квадрат с краю листа. А маленький – по центру.
И наоборот, большой квадрат в центр листа. А маленький – в угол.
Какой из них более гармоничный?
У каждого человека есть личные предпочтения. Одни считают гармоничным и равновесным одно, другие – другое. Почти невозможно объяснить принцип гармонии и неравновесности на расстоянии, отдалённо. Каждый разрабатывает для себя систему гармонии и неравновесности самостоятельно. И потом, если это входит в его задачи, тестирует систему на других людях. Проверяя её.
Выработать свою собственную систему гармонии можно только на практике. И проверке на других людях.
Правило гармонии и неравновесности выполняется как для форм на рисунке, так и для цветов и тонов, которые использованы при рисунке. Цвет – это красный, синий и т.д. Тоны – темнее, светлее, очень темно, очень светло. Один цвет может иметь много тонов. Один цвет может иметь много оттенков – жёлтый может быть более красным, менее красным, более зелёным и т. д. Все эти особенности так же находятся друг по отношению к другу либо в гармонии, либо в неравновесности.
д. Все эти особенности так же находятся друг по отношению к другу либо в гармонии, либо в неравновесности.
Гармония и неравновесность в чистом виде достигаются той или иной комбинацией изображений объектов и цветовыми сочетаниями.
Третье правило. Силовые линии. Оно немного похоже на второе правило. Некоторые люди добиваются гармонии или неравновесности с его помощью. Но силовые линии – это другое.
Небольшое упражнение. Возьмите картину, которая наиболее вам понравилась.
Например, «Мадонну» Леонардо да Винчи.
И теперь следите за рукой Младенца, которой он тянется к лицку Мадонны. Линии этой руки плавно перетекают в волосы Мадонны. Контур волос плавно обходит лицо, спускается к плащу и линия продолжается складками плаща. Складки плаща теряются под рукой Мадонны с ягодами. Однако, силовая линия продолжается складками одежды над локтем, перетекает в руку с ягодами, к нижней руке Младенца.
Линия верхней руки младенца переходит так же и в силовую линию его головы, в силовую линию лица Мадонны.
Точно так же, как и руки, объеденены силовой линией и ноги Младенца. Начало линии задают пальцы руки Мадонны. Это направление продолжается правой ногой Младенца и переходит в линии складок плаща. Левая нога Младенца продолжается силовой линией с одной стороны – в складках плаща, а с другой – в его теле, переходит к голове.
Посмотрите, как силовые линии объединяют передний план с фигурами и фон в окнах на заднем плане. В левом окне линия ближайшего холма переходит в линию подбородка Младенца. Линия дальней горы в левом окне переходит в силовую линию внешней стороны лица Младенца.
Точно так же «входит» в пейзаж Мадонна. Линия ближайшего холма продолжается складками плаща. Склоны гор так же сходятся на линиях плаща. Заметьте, что линия ближайшего левого холма и линия ближайшего правого холма продолжаются в ожерелье мадонны и сходятся друг с другом на украшении. Кстати, украшение – это зрительный центр картины, точка пересечения большинства силовых линий.
Надеюсь, вы заметили эти особенности. Перечисленные линии не являются всеми, которые есть на картине. Я не знаю, расчитывал ли Леонардо да Винчи эти линии при разработке композиции «Мадонны», или нет. Но эти линии присутствуют. И благодаря им композиция оказывается не только гармоничной и равновесной, но и связанной. Композиция не распадается на части. Она является цельной.
Таким образом,
линии, которые можно чётко проследить вне зависимости от объекта на каждом изображении – это силовые линии.
Они называются силовыми потому, что они несут на себе всю картину, её целостность. Убрать их, расположив предметы по-другому – и картина распадётся на части, станет слабой. Силовые линии – это то, что объединяет изображения объектов. Это могут быть как реальные линии, так и воображаемые. Они исчезают и появляются. Однако, если они прослеживаются, то картина целостна.
С другой стороны, силовые линии – это то, что выражает характер объекта. Если меняется их сочетание, то меняется объект. Силовые линии – это то, что останется, когда убрать все неважные, незначащие и несущественные детали предмета. Убрать всё, что безоговорочно не характеризует предмет. Силовые лини – это скелет идеи предмета. Его эйдос, идеальный образ.
Предметы взаимодействуют на рисунке с помощью силовых линий. Они либо общаются, либо оторваны друг от друга. Силовыми линиями показывается отношение предметов друг к другу.
Силовые линии имеют разную плотность, могут образовывать точки схождения – эпицентры. На картине их может быть несколько или же один. Может не быть вообще. В зависимости от этого меняется характер картины.
Научится пользоваться силовыми линиями просто – нужно наблюдать. За уже сделаными картинами, за тем, что вы рисуете. И в какой-то момент, когда накопится фактический материал, вы поймёте, как это применить к вашим конкретным задачам. Тем более что практически всё живое содержит в себе очень много силовых линий.
Итак, сначала наблюдать на примерах, а потом – рисовать самим.

Как перечисленные правила применяются? Очень просто. Если вам хочется нарисовать движение, то уравновешенным это изображение быть не может. Потому что движение – это не покой. В движении нет равновесия, есть стремление куда-то. Силовые линии сходятся к цели движения. Если вы хотите изобразить статичную картину, то отсутствие гармонии точно не позволит вам этого достичь. Когда нет гармонии, взгляд зрителя рыщет по картине, создавая движение.
В статичной картине должно быть равновесие. Все части увязаны друг с другом. Объеденены силовыми линиями в единое целое. Силовые линии не имеют эпицентров или же имеют один чётко определяемый эпицентр.
С помощью комбинаций этих правил вы можете добиться огромного количества возможных нюансов и настроений, когда части картины переплетаются друг с другом в запланированном вами порядке, и, даже, возможно, вписываются в интерьер вашей комнаты, силовые линии которой продолжают линии картины. Ну, а теперь, собственно, указание по тренировке композиции:
Тренируйтесь выражать гармонию и неравновесность, силовые линии и расположение рисунка на бумаге до того уровня, когда вы почувствуете, что освоили этот шаг полностью.
Продолжение – в статье «Приступаем к рисованию».
По материалам http://wozmoznosti.narod.ru/drow/yegor/step4.html
Основы композиции в конструктивных искусствах. Гармония, контраст и эмоциональная выразительность плоскостной композиции
1. Презентация по изобразительному искусству на тему: «Основы композиции в конструктивных искусствах. Гармония, контраст и
ПРЕЗЕНТАЦИЯ ПО ИЗОБРАЗИТЕЛЬНОМУИСКУССТВУ НА ТЕМУ:
«ОСНОВЫ КОМПОЗИЦИИ
В КОНСТРУКТИВНЫХ ИСКУССТВАХ.
ГАРМОНИЯ, КОНТРАСТ И
ЭМОЦИОНАЛЬНАЯ
ВЫРАЗИТЕЛЬНОСТЬ
ПЛОСКОСТНОЙ КОМПОЗИЦИИ»
Выполнила: учитель искусства
МОБУ СОШ № 1 имени И.Д.Бувальцева
Краснодарский край г. Кореновск
Попович Галина Ивановна
2. элементы композиции
Оформление обложки книгиПусть вас не смущает то
обстоятельство, что все
упражнения делаются при
помощи прямоугольников.

Во-первых, они достаточно
выразительны и, не
отвлекая многообразием
форм, позволяют легче
усвоить композиционные
приемы. Во-вторых, они
прообраз будущих
компоновок текстовых масс
и иллюстраций.
3. Все прямоугольные элементы композиции следует вырезать из черной или белой бумаги (в зависимости от выбранного фона). Прежде
Все прямоугольные элементы композиции следует вырезать из черной или белой бумаги (в зависимости отвыбранного фона). Прежде чем окончательно приклеить, их нужно подвигать по листу в поисках лучшего варианта
компоновки, уменьшить или увеличить их размер, добиваясь сбалансированности композиции.
4. Создать конфликт между белым полем и черным пятном. Сюжет, если хотите — интрига, конструктивной композиции как раз и состоит
Создать конфликт между белым полем и черным пятном. Сюжет, если хотите —интрига, конструктивной композиции как раз и состоит в противопоставлении,
контрасте, соотношении масс (в данном случае — прямоугольников).
5. ПРАКТИЧЕСКАЯ РАБОТА
Выполним упражнения наисследование принципов
равновесия и движения в
плоскостной композиции.
Элементами композиции выберем
прямоугольники. Согнем лист А4
пополам и еще раз пополам —
получим четыре прямоугольника
для четырех упражнений. Эти
упражнения можно выполнить и на
компьютере.
Упражнение 1. Баланс масс.
Рассмотрим белый прямоугольник,
оценим белое пространство и
подберем к нему черный
прямоугольник такого размера,
чтобы черный и белый цвета были
уравновешены, сбалансированы
6. Упражнение 2.
Динамика масс. Усложнимзадание и поместим
черный прямоугольник под
углом к белой плоскости.
Что интереснее?
Выразительнее? Черный
прямоугольник благодаря
своему расположению
рождает ощущение
«движения». Вводя в
композицию
дополнительные элементы,
можно усилить ощущение
движения, а можно,
наоборот, «остановить» его
7.
 Симметрия Равновесие композиции часто
Симметрия Равновесие композиции частосвязывают с симметричностью.
Симметрия с древних времен
считалась одним из условий
красоты. Древние греки полагали,
что Вселенная симметрична просто
потому, что симметрия прекрасна.
Идея симметрии часто являлась
отправным пунктом в гипотезах и
теориях ученых прошлых веков,
веривших в математическую
гармонию мироздания. Понятие
симметрии не ограничивается
симметрией объектов. Оно
распространяется также на
физические явления и
управляющие ими физические
законы. Именно симметрия
позволяет нам охватить самые
разнообразные тела с единых
позиций. «Симметрия» в переводе
с греческого означает
«соразмерность»
8. Асимметрия
Способ гармонии, при которомизображение слева подобно правому,
верх аналогичен низу по диагонали,
горизонтали, вертикали или по другой
ломаной оси, называется симметрией, а
сама композиция симметричной.
Симметрия достигает гармонии путем
исчезновения изобразительного
14 лет конфликта, а сама композиция
превращается в орнамент. В результате
возникает однообразие и
монотонность. Вспомним у Пушкина в
«Пиковой даме»: «В печальной
симметрии стояла мебель у старухи».
Асимметрия позволяет добиться
динамичности, напряженности
композиции, не теряя гармонии целого.
При использовании асимметрии
композиция становится выразительнее,
интереснее. При асимметрии ось или
плоскость симметрии отсутствуют
(столик Гауди)
9. Если симметричная равновесная форма воспринимается легко и сразу, то асимметричная динамичная читается постепенно.
Сбалансированной, равновесной композиции В. Лебедева можно противопоставитьдинамичную, асимметричную композицию Д. Штеренберга
10. Питер Корнелис Мондриан — художник-абстракционист,
Питер Корнелис Мондриан — художникабстракционист,Поискам равновесия и баланса посвятил жизнь создавший и
возглавивший группу «Стиль», которая оставила яркий след в
истории современного искусства.
 В своих произведениях он
В своих произведениях он«уничтожил» динамику. Его композиции совершенно
равновесны и безукоризненно сбалансированы. Помимо этого
Мондриан был также основоположником «неопластицизма»
— строгого абстрактного направления, основанного на
использовании в качестве основного композиционного мотива
решетки из пересекающихся горизонтальных и вертикальных
линий. В течение тpидцати лет своей жизни
он священнодействовал над холстами, pазгpафлял
их на пpямоугольники и квадpаты и закpашивал получившиеся
геометpические поля то интенсивными яpкими кpасками,
то (позднее) облегченными и пpозpачными оттенками белого,
сеpого, бежевого или голубоватого
11. Упражнение 3. Симметрия. Белая плоскость уже задана. Вырезаем несколько черных или цветных прямоугольников и выполняем
симметричную композицию.12. Ритм
Среди композиционных закономерностей следуетвыделить группу средств, объединенную понятием
ритм. Само слово «ритм» в переводе с
древнегреческого означает «такт» или
«соразмерность». Мы живем в мире меняющихся
ритмов. Приложите руку к груди, послушайте ритм
сердца — равномерный и спокойный. Прислушайтесь к
ритмам города — звуку машин, шагов, порывам ветра,
стуку капель дождя. Ритм можно воспринимать не
только на слух, но и зрительно. Понаблюдайте за
чередованием света и теней во время движения.
Однако ритм свойственен не только движению, но и
статическому предмету. Посмотрите на ряды парт в
классе, на чередование оконных проемов в коридорах
школы. Ритм благодаря повторам элементов создает
впечатление условного движения.
Чередование изобразительных элементов и свободных
пространств, их частота, сгущенность и разреженность
называются ритмом. Ритм может быть спокойным и
беспокойным, устремленным в одну сторону или
сходящимся к центру, направленным как по
горизонтали, так и по вертикали. Чередовать можно
элементы, объемы, цветовые пятна, какие-то детали и
др.

13. Контрасты являются воздействующей силой композиции и определяют ее выразительность. Контраст — это резко выраженная
противоположность:длинный — короткий, толстый — тонкий, крупный — мелкий. Контраст составляет
одно из основных средств композиции.
Существуют контрасты величин, объема и
плоскости, света и тени (тональные
контрасты), теплых и холодных цветов,
разных фактур и др. Контрастные
сопоставления способствуют обострению
восприятия целого. Контраст усиливает,
подчеркивает различие свойств формы,
делает их единство более напряженным,
впечатляющим. Очень сильный контраст
может зрительно разрушить
композиционный строй, поэтому степень
применяемого контраста ограничивается
требованием сохранения цельности
впечатления.
В форме, пропорциях, цвете контраст
подчеркивает явно выраженную
противоположность, а нюанс несет в себе
едва заметный переход, оттенок. Нюанс,
как и контраст, — способ проявления
выразительности в композиции. С
выразительностью в композиции тесно
связана гармоничность, основной задачей
которой является создание впечатления
уравновешенности, изящества и точности
произведения (Эль Лисицкий. плакат
«Красным клином бей белых». 1920)
14. Упражнение 4. Ритм. Выполним ритмическую композицию, используя линии и прямоугольники , круги и точки.
Можновыполнить
задание,
вырезая
ритмически
чередующи
еся линии .
Все
элементы
композиции
желательно
вырезать не
ножницами,
а макетным
ножом.
15. Статичная фронтальная композиция
Статичная фронтальнаякомпозиция или более
динамичная глубинная
композиция должна строиться
на разности величин
прямоугольников. Доминанта —
центр внимания в композиции
(рис. 2). Доминанта — это не
всегда самый крупный элемент
композиции, это может быть
самая мелкая обособленная
форма, создающая пластический
конфликт.

Как достигается баланс масс,
можно в композиции
«наезжать» прямоугольниками
друг на друга. Фигура в границах
«наезда» должна быть белой,
если прямоугольники черные,
и наоборот
Обратите внимание на такой
банальный момент работы, как
подпись. Позаботьтесь, чтобы
подпись была поставлена
с оборотной стороны листа и
карандашом. В дальнейшем, после
знакомства со шрифтом, можно
сочинить свое клеймо, свой знак,
которым каждый будет помечать
свои работы, в том числе и макеты.
КОМПОЗИЦИЯ. ПОИСК ГАРМОНИИ — Фокус на объекте — Приемы кино — Приемы и ходы
14. Ошибка: Фрустрирующее движение взгляда
Это движение должно быть строго упорядоченным, иначе композиция будет восприниматься как нечто не имеющее основы. Если при помощи указки акцентировать внимание аудитории на объекте, не представляющем интереса, получится эффект, сравнимый с возникающим от просмотра такой композиции. И как следствие — у аудитории возникнут замешательство и раздражение. Сильный вектор движения, никуда в изображении не приводящий, — это фрустрирующее путешествие.
15. Улучшение: Оправдание динамического равновесия (неравновесия)
В соответствии с законом перцептивной «реорганизации» ни один зрительный элемент, находящийся в рамках изображения, не может существовать изолированно. При восприятии глаз/мозг выделяет группы схожих элементов и обобщает их в некие формы. 15. В основе одного из видов соотношения элементов лежит принцип равновесия, то есть зрительный вес одной организованной группы объектов сравнивается с весом другой группы, а также соотносится вес всех элементов, включенных в группы.
1) Симметричная равновесная система
2) Равновесие по массе
3) Устойчивая фигура
4) Неустойчивая фигура
Наш жизненный опыт и представления о природе физического устройства мира подсказывают нам, что большой объект на маленьком основании не будет достаточно устойчивым и легко может опрокинуться. Так же будет восприниматься и композиция, в которой крупные объекты находятся сверху, а мелкие — снизу. Такая композиция производит впечатление нестабильной и временной.
Так же будет восприниматься и композиция, в которой крупные объекты находятся сверху, а мелкие — снизу. Такая композиция производит впечатление нестабильной и временной.
16. Улучшение: Оправдание значения конкретной диспозиции объектов
Найти динамическое равновесие означает не только правильно расположить крупные и небольшие элементы, соблюсти свето-теневые переходы и т. п., но и так объединить образы, входящие в изображение, чтобы обеспечить смысл диспозиции (объединение объектов, их противопоставление и т.д.)
17. Изменение: Преодолеть однообразие гармонии за счет упорядоченной дисгармонии
В то время как композиционный баланс призван создать чувство равновесия и устойчивости, применяемый при построении композиции диссонанс дает ощущение неуверенности или неразрешенности вопроса. Вряд ли обычный человек, бесцельно нажимая на клавиши пианино, сможет создать эффективный музыкальный диссонанс, если только случайно. В основе-музыкального диссонанса лежит принцип гармонии. При построении изображения диссонанс также основывается на строгих правилах, благодаря которым достигается упорядоченная дисгармония.
18. Изменение: Создать зрительное напряжение за счет диссонанса.
Для хорошей композиции дисбаланс не менее важен, чем упорядоченность. Отступая от строгой упорядоченности, мы усиливаем интерес к изображению. Полностью сбалансированная композиция удовлетворяет тягу человека к симметрии, но быстро становится неинтересной. Если сравнить упорядоченность с чувством сытости, то дисбаланс можно назвать аппетитом, который требует насыщения. На протяжении многих веков западное изобразительное искусство развивалось под знаком объединения элементов изображения в некое графическое единство — под знаком достижения баланса. Концепция диссонанса, в основе которого лежит умышленное противопоставление элементов композиции с целью создания зрительного напряжения, начала входить в практику живописи лишь в конце XIX века. Аналогично тому, как нам хочется поправить криво висящую на стене картину, возникает желание достроить и сбалансировать изображение, построенное на «хорошем» диссонансе. Разногласия и конфликт в композиции могут, с одной стороны, вызвать сильное чувство неразрешенного напряжения, но с другой — подогревают интерес и усиливают чувство вовлеченности в процесс.
Аналогично тому, как нам хочется поправить криво висящую на стене картину, возникает желание достроить и сбалансировать изображение, построенное на «хорошем» диссонансе. Разногласия и конфликт в композиции могут, с одной стороны, вызвать сильное чувство неразрешенного напряжения, но с другой — подогревают интерес и усиливают чувство вовлеченности в процесс.
Диссонанс при группировании объектов в композиции вызывает чувство несогласия. При смещенных границах кадра и выходе линии движения взгляда за пределы изображения снимаемая сцена воспринимается несбалансированной и вызывает чувство зрительного дискомфорта. Если объект находится в изображении, построенном по принципу диссонанса, динамическое напряжение усиливается. Но чрезмерная несбалансированность композиции может вызвать ее разрушение и превращение в ряд случайных, ничем не связанных элементов.
Абстрактная композиция | Арт-Гряда
По определению, согласимся с Википедией, Абстракционизм (лат. аbstraction — удаление, отвлечение) или нефигуративное или беспредметное направление искусства, отказавшееся от приближённого к действительности изображения форм в живописи, графике и скульптуре.
В основу эстетической концепции первых абстракционистов был положен отказ от реальной формы, которая требует от зрителя эрудированности и логического осмысления, в угоду выражения как минимум чистого эмоционального посыла. Как максимум предполагалось, что художественное творчество отражает закономерности мироздания, скрытые за внешними, наносными явлениями действительности. Эти закономерности, интуитивно постигаемые художником, выражались через соотношение абстрактных форм (цветовых пятен, линий, объёмов, геометрических фигур) [1, С. 42-43].
Рис. 1. В. В. Кандинский. Первая абстрактная акварель. 1910 г.
Широко используемый термин абстрактная композиция вырастает из сферы образования, где определяет формулировку учебного упражнения. Слово «композиция» используется не в значении составления, а в аспекте законченного произведения. Вернее, конечно, говорить о композиции в абстрактном искусстве. Как искусство «личного переживания» абстракционизм в различные периоды существования шокировал зрителя, составлял авангард искусства, затем высмеивался, подвергался осуждению и цензуре, как искусство, не имеющее никакого смысла и дегенеративное. Однако теперь абстракционизм существует наравне со всеми другими формами искусства и, более того, выходит на особые позиции заданий вступительных испытаний при поступлении в образовательные учреждения на архитектурно-дизайнерские специальности. В качестве проверки креативных возможностей абитуриента испытание абстракцией весьма продуктивно т.к. ярко выявляет творческое мышление, композиционные знания и умение выразить тему в усложнённых условиях запрета на узнаваемые формы окружающего мира. Ведь исторически, работая с первичными элементами языка искусства (те геометрические формы из которых методом отрезания лишнего в фигуративном искусстве можно получить объекты зрительного мира), абстракционисты обращались к общим для всего изобразительного искусства композиционным принципам. Неудивительно, что абстракционисты находили применение своим неизобразительным формам в промышленной эстетике (дизайне), художественном конструировании, архитектуре (деятельность группы «Стиль» в Нидерландах и школы Баухауз в Германии; работа Кандинского воВХУТЕМАСе; архитектоны и дизайнерские проекты Малевича; «мобили»Александра Колдера; конструкции Владимира Татлина, работы Наума Габо и Антуана Певзнера). Деятельность абстракционистов способствовала становлению современной архитектуры, декоративно-прикладного искусства, дизайна [1, С. 42-43].
Вернее, конечно, говорить о композиции в абстрактном искусстве. Как искусство «личного переживания» абстракционизм в различные периоды существования шокировал зрителя, составлял авангард искусства, затем высмеивался, подвергался осуждению и цензуре, как искусство, не имеющее никакого смысла и дегенеративное. Однако теперь абстракционизм существует наравне со всеми другими формами искусства и, более того, выходит на особые позиции заданий вступительных испытаний при поступлении в образовательные учреждения на архитектурно-дизайнерские специальности. В качестве проверки креативных возможностей абитуриента испытание абстракцией весьма продуктивно т.к. ярко выявляет творческое мышление, композиционные знания и умение выразить тему в усложнённых условиях запрета на узнаваемые формы окружающего мира. Ведь исторически, работая с первичными элементами языка искусства (те геометрические формы из которых методом отрезания лишнего в фигуративном искусстве можно получить объекты зрительного мира), абстракционисты обращались к общим для всего изобразительного искусства композиционным принципам. Неудивительно, что абстракционисты находили применение своим неизобразительным формам в промышленной эстетике (дизайне), художественном конструировании, архитектуре (деятельность группы «Стиль» в Нидерландах и школы Баухауз в Германии; работа Кандинского воВХУТЕМАСе; архитектоны и дизайнерские проекты Малевича; «мобили»Александра Колдера; конструкции Владимира Татлина, работы Наума Габо и Антуана Певзнера). Деятельность абстракционистов способствовала становлению современной архитектуры, декоративно-прикладного искусства, дизайна [1, С. 42-43].
Лично автору интересна абстрактная композиция только тем, что на примере условных абстрактных форм легче понять психофизиологические законы восприятия зрителем изображения и поставить их на вооружение при выявлении авторской мысли в произведении. Ведь чтобы сделать свои идеи доходчивыми для зрителя логично общаться на понятном для зрителя и художника изобразительном языке, о чем писал доктор искусствоведения Степанов Г. П. (Композиционные проблемы синтеза искусств, 1984). На языке общечеловеческих гештальтов психики Р. Арнхейма (Искусство и визуальное восприятие. 1974) с учётом физиологии рассматривания и обработки увиденного мозгом, которые обобщил для художников в своей книге Г.И. Панксенов (Живопись. Форма, цвет, изображение, 2007). Эта тема подробно расписана автором в статьях «Неоднородность изобразительной плоскости» и «Смысловые основы композиции», которые увеличат понимание этой статьи. Обратим внимание на то, что даже когда эскизируются первые идеи предметной (жанровой или сюжетной, ассоциативно-сюрреалистичной, декоративной и др.) композиции*, все объекты в ней намечаются условными пятнами или массами, которые потом методом «отсечения» лишнего доводятся до узнаваемых форм. Теория композиции однозначно диктует, что именно в условных массах большого и малого, тёмного и светлого на стадии первых неявных эскизов должно быть найдено взаимодействие, гармония, композиционный центр, средства выразительности и бережно сохраняется до конца работы над произведением.
П. (Композиционные проблемы синтеза искусств, 1984). На языке общечеловеческих гештальтов психики Р. Арнхейма (Искусство и визуальное восприятие. 1974) с учётом физиологии рассматривания и обработки увиденного мозгом, которые обобщил для художников в своей книге Г.И. Панксенов (Живопись. Форма, цвет, изображение, 2007). Эта тема подробно расписана автором в статьях «Неоднородность изобразительной плоскости» и «Смысловые основы композиции», которые увеличат понимание этой статьи. Обратим внимание на то, что даже когда эскизируются первые идеи предметной (жанровой или сюжетной, ассоциативно-сюрреалистичной, декоративной и др.) композиции*, все объекты в ней намечаются условными пятнами или массами, которые потом методом «отсечения» лишнего доводятся до узнаваемых форм. Теория композиции однозначно диктует, что именно в условных массах большого и малого, тёмного и светлого на стадии первых неявных эскизов должно быть найдено взаимодействие, гармония, композиционный центр, средства выразительности и бережно сохраняется до конца работы над произведением.
Рис. 2. Эскизы картин. а) И.И. Левитан. Платформа. Приближающийся поезд. Набросок. 1879. ГТГ. б) Спиридонов В. М. Многофигурная композиция. Эскиз 1941 г. Чувашский гос. музей. в)
Кипарисов П. Г. Марийки Идут. Эскизы к картине «Когда Цветет Сирень». Чувашский гос. музей.
Этот подход роднит все ипостаси композиции (жанровая, абстрактная ассоциативная, декоративная и т.д.). Конечно в абстракции мы можем приблизить зрителя лишь к какому-либо психологическому переживанию, настроению, ощущению, но это уже совсем не мало для произведения и предметного характера. Поэтому понимание композиции в абстракции расширит горизонты и художников фигуративных направлений в искусстве. Именно с этих позиций выдвинем гипотезу о том, что понимание связи психологического с изобразительным должно стать базовым принципом выражения определенных ощущений в композиционном знании. Это позволит художнику более точно выражать свою мысль и создавать более мощное эмоциональное воздействие на зрителя в произведении как фигуративного характера, так и не фигуративного.
Однако все ли рисовальщики понимают принципы отображения тех или иных ощущений, той или иной ассоциации, настроения в беспредметной композиции, с помощью какого кодированного языка должны разговаривать автор и зритель посредством изображения?
*Всё изобразительное искусство можно поделить на предметное и беспредметное. И тот и другой раздел можно представить как совокупность направлений в искусстве, например в абстрактном искусстве два больших направления геометрическая абстракция, основанная преимущественно на четко очерченных конфигурациях (Малевич, Мондриан) и лирическая абстракция, в которой композиция организуется из свободно текущих форм (Кандинский). В их рамках можно выделить более узкие течения, например, ташизм (живопись пятнами, которые выражают бессознательную активность художника), супрематизм (комбинациях разноцветных плоскостей простейших геометрических очертаний), неопластицизм (живопись в компоновке крупных прямоугольных плоскостей, окрашенных в основные цвета спектра) и т.д. В предметной живописи вмешиваются различные подходы к изображению самой реалистичной формы, действия, времени, пространства. Например, жанровая реалистичная композиция, т.е. отражающая определенный жанр искусства (портрет, натюрморт, пейзаж, анималистический, исторический, батальный, бытовой или т.п.) чётко придерживается Аристотелевых единств — времени, места, действия. В таком искусстве определенные действующие лица в определенный момент времени в реальном пространстве объединены одним действием. Однако, в предметном искусстве исторически сложились и такие направления как сюрреализм, кубизм, футуризм и иные «предметные» авангардные течения, где предметы окружающего мира со значительной степенью стилизации (деформация, упрощения, усложнения и т.д.) или без нее изображаются не в условиях реального физического мира, а как бы в потоке ассоциативных рефлексий автора. Иными словами, есть реальные объекты, но времена, пространства могут смешиваться, цвет трактоваться условно, а форма сильно деформироваться. «Уже период протоавангарда рубежа XIX—XX веков характеризуется как слом, переход от классической эстетики Аристотеля, мимесиса к неклассической, антиаристотелевской традиции» [2, С. 23]. Но, при всём при этом, законы, правила, принципы, средства выразительности едины для всех проявлений и производят заложенное автором воздействие в любых вариантах предметного или беспредметного изображения.
«Уже период протоавангарда рубежа XIX—XX веков характеризуется как слом, переход от классической эстетики Аристотеля, мимесиса к неклассической, антиаристотелевской традиции» [2, С. 23]. Но, при всём при этом, законы, правила, принципы, средства выразительности едины для всех проявлений и производят заложенное автором воздействие в любых вариантах предметного или беспредметного изображения.
Цель данной статьи заключается в попытке описать адекватные принципы, по которым в абстрактной композиции выявляются человеческие ощущения, а вместе с тем объяснить методику размышлений о выражении в композиции жизненных ощущений на примере стандартных для учебных заданий по композиции и формообразованию тактильных, вкусовых, вестибулярных и др. ощущений. Для чего проанализируем особенности композиции в абстрактном искусстве и приведем несколько примеров с иллюстрациями.
Для выражения статики в композиции характерны:
Тяжелый низ и лёгкий верх – это психологическое предвосхищение (ожидание) расстановки сил в листе, которое обусловлено физическими реалиями жизни. Иными словами, от привычки ощущать под ногами надёжную опору, а над головой лёгкое светлое небо. Поэтому композиционный центр лучше закладывать чуть ниже геометрического центра листа дабы усилить низ, притянуть композицию к подразумеваемой платформе. Ассоциативно ощущаемая у нижнего края листа площадь опоры необходима большая в связи с физическим законом о том, что большая плоскость дает большую силу трения. В связи с жизненным опытом нахождения равновесных устойчивых состояний необходимо подчёркивать вертикали и горизонтали в качестве композиционного ключа или доминирующего принципа в композиции. Ничего не стоит ставить на угол. Даже треугольники в композиции, которые привносят диагонали своими сторонами надо ставить на широкое основание, стремится к равнобедренным и прямоугольным треугольникам. Цвет на вестибулярные ощущения по мнению автора не влияет.
Для выражения динамики в композиции характерны:
В связи со сложившимся «Арнхеймовским» гештальтом психики ощущать над головой лёгкое светлое небо, часто при рассматривании изобразительной плоскости помещенные в верхней части листа предметы кажутся летящими или падающими. Поэтому композиционный центр в динамичных композициях лучше закладывать чуть выше геометрического центра листа с целью сместить акцент для зрителя как бы «в небо». Рискнём предположить, что тёмные объекты и крупные, которые ассоциативно связываются с тяжестью кажутся падающими, а лёгкие и светлые, по аналогии с пухом, снегом, паром и т.д., кажутся летящими. Площади опоры в нижнем крае листа абсолютно не нужна. В отличии от статики структура динамичной композиции — это чаще всего диагональ. Может быть и спираль, но при спирали впечатление постоянного удаления и полёта надо «дожимать» ритмом и масштабом. Обратите внимание, что под динамикой подразумевается не хаотичное движение, а векторно-направленное, как бы с заданным ускорением. Иными словами, изображенные объекты должны казаться летящими (брошенными с силой) к конкретной цели. Такие статичные формы как различные прямоугольники надо ставить на угол, по диагонали. Основное средство выразительности — ритм. Меняя расстояние от одного нарисованного объекта к другому, художник может создавать ощущение разгона или замедления, в зависимости от того насколько далеко нужно перепрыгнуть взгляду от одного объекта к другому. Вместе с тем неплохим подспорьем будет и эффект перспективного сокращения улетающих объектов. Цвет на вестибулярные ощущения, по мнению автора, не влияет.
Поэтому композиционный центр в динамичных композициях лучше закладывать чуть выше геометрического центра листа с целью сместить акцент для зрителя как бы «в небо». Рискнём предположить, что тёмные объекты и крупные, которые ассоциативно связываются с тяжестью кажутся падающими, а лёгкие и светлые, по аналогии с пухом, снегом, паром и т.д., кажутся летящими. Площади опоры в нижнем крае листа абсолютно не нужна. В отличии от статики структура динамичной композиции — это чаще всего диагональ. Может быть и спираль, но при спирали впечатление постоянного удаления и полёта надо «дожимать» ритмом и масштабом. Обратите внимание, что под динамикой подразумевается не хаотичное движение, а векторно-направленное, как бы с заданным ускорением. Иными словами, изображенные объекты должны казаться летящими (брошенными с силой) к конкретной цели. Такие статичные формы как различные прямоугольники надо ставить на угол, по диагонали. Основное средство выразительности — ритм. Меняя расстояние от одного нарисованного объекта к другому, художник может создавать ощущение разгона или замедления, в зависимости от того насколько далеко нужно перепрыгнуть взгляду от одного объекта к другому. Вместе с тем неплохим подспорьем будет и эффект перспективного сокращения улетающих объектов. Цвет на вестибулярные ощущения, по мнению автора, не влияет.
Рис. 3. Примеры изображения статики и динамики в геометрической абстрактной композиции. а) Юлдашева Е. б) Лазарева В. в) Лазарева В.
Для выражения массивного в композиции характерно:
Для выражения тяжести в листе композиционный центр лучше закладывать чуть ниже геометрического. Формат удачнее выбрать горизонтальный, как бы «приземленный». В частных случаях для массивности площадь опоры должна быть, причем чем больше, тем лучше (в том числе и суммарная нескольких тяжелых объектов) в связи с тем, что тяжелая масса сильнее притягивается к земле. Необходимо прижать изображение к нижнему краю листа. Однако могут встречаться различные художественные задачи, при которых массивное не должно быть связано с землей, тогда стоит ограничится лишь большим масштабом в листе и тёмным тоном. Ярко выраженной структуры для создания массивных композиций, наверное, нет, однако интересно усиливать ощущение тяжести, духоты и давления за счет того, что графически можно зажать или придавить мелкий объект крупными, по аналогии с завалами. Стараться изображать объекты плотно, без видимых между ними просветов. Для весовых ощущений намного большее значение влияет тон: светлый или тёмный, — нежели цвет. Так для выявления ощущения массивности на помощь должны прийти тёмные тона. Это связано опять же с жизненным опытом, который ассоциативно связывает тяжелые тона с ожидаемой до опыта (априори) тяжестью. В том числе, образно темнота связывается с тяжелыми эмоциональными состояниями человека. А так-как из курса цветоведения известно, что к каждому цвету можно подобрать соответствующий по силе тон, то естественно для массивного подходят тёмные цвета коричневые, синие, фиолетовые, тёмно-зеленые, тёмно-бардовые цвета и иные тёмные оттенки цветов. Основное средство выразительности – масштаб. Это связано опять же с жизненным опытом, который ассоциативно связывает огромный размер с ожидаемой тяжестью объекта.
Для создания ощущения лёгкости в композиции характерно:
Для лёгкого композиционный центр лучше проектировать чуть выше геометрического центра листа чтобы связать самое главное в композиции с чем-то парящим, возвышенным. Даже формат скорее всего следует выбирать вертикальный. В частных случаях, связанных со статикой или устойчивостью, точки опоры будут нужны, но для большего выражения лёгких конструкций они должны быть точечные (не сплошные), визуально тонкие опоры, вне зависимости от площади опоры. Однако могут встречаться различные художественные задачи, динамического характера. Тогда стоит ограничится лишь выражением идеи с помощью масштаба и светлого тона. Ярко выраженную структуру композиции выделять здесь бессмысленно, однако интересно усиливать ощущение лёгкости обилием «воздуха» между объектами в изображении. Вместе с тем отличным художественным приёмом для подчёркивания лёгкости станет так называемое «рисование насквозь» или «сквозь предмет», создавая впечатление прозрачности изображенных объектов. Также хорошо изображать объекты полыми, ассоциативно облегчая их массу. Для выявления ощущения лёгкости по аналогии с жизненными реалиями подходят светлые тона, по аналогии с пухом, снегом, паром и т.д. А так-как из курса цветоведения известно, что к каждому цвету можно подобрать соответствующий по силе тон, то естественно лёгкое связано со светлыми оттенками цветов: желтые, розовые, оранжевые, голубые, светло-зеленые. Основное средство выразительности – масштаб. Это связано опять же с жизненным опытом, который ассоциативно связывает маленький размер с заведомо известной лёгкостью объекта.
Рис. 4. Примеры изображения массивного и лёгкого в геометрической абстрактной композиции. а) Беляева Е., б) Лазарева В., в) Юлдашева Е.
Для создания ощущения устойчивости и неустойчивости в композиции важно:
Эти две темы неразрывно связаны с человеческим представлением о плоскости земли, пола, подиума, опоры. Конечно не обязательно эти плоскости должны быть нарисованы, но они могут подразумеваться и подчёркиваться концентрацией линий. Устойчивое будет отличаться от статики лишь ощущением того, что статичное простоит века, а устойчивость явление мимолётное. Если статику, как мы понимаем, порушить сложно, то устойчивое разрушается при небольшом усилии. Чтобы безапелляционно присутствовало ощущение устойчивости в графической конструкции площадь опоры (в том числе и суммарная нескольких объектов) может быть и не большой, однако суммарная проекция композиционного центра всей конструкции на плоскость предполагаемого «пола» должна попадать в площадь опоры. Наоборот, если проекция центра тяжести выходит за площадь опоры, то возникает ощущение развала, падения, разрушения. Формат при этом рекомендуем выбирать вертикальный. Композиционный центр располагать выше геометрического.
Рис. 5. Примеры изображения устойчивого и неустойчивого в абстрактной геометрической композиции. а) Лазарева В., б) Юлдашева Е.
Для выражения вкусовых ощущений кислого для композиции важно:
На взгляд автора для выражения вкусовых ощущений огромную роль играет цвет. С кислым из жизни ассоциативно связываются яркие цвета лимона, лайма, ананаса, грейпфрута и др. Поэтому нам подходят все холодноватые оттенки желтого, зеленого, изумрудный, голубой, синий, фиолетовый. Естественно, перечисленных цветов может не хватать для задумки автора-композитора. В то же время не следует обеднять свою композицию перечисленными цветами. Следует запомнить только одно правило – 75% процентов холодных кислых цветов и 25% иных. Следует чётко понимать, чем больше вы вносите в композицию элементов из противоположных ощущений, тем больше у вас появляется посторонних ассоциаций, что противоречит принципам цельности композиции, когда каждый элемент должен работать на выражение генеральной идеи автора. Формообразование в композиции происходит опять же за счет образов реальной жизни. Вспомните свои ощущения от поедания лимона. Ротовую полость словно режет, колет, щиплет, поэтому и формы в композиции следует использовать колкие, игольчатые, острые, ершистые.
Для выражения вкусовых ощущений сладкого для композиции важно:
Ассоциативно из жизни со сладким связаны тёплые оттенки жёлтого, зелёного, вместе с тем оранжевый, красный, коричневый. По поводу иных цветов действует точно такое же правило: 75% процентов ассоциирующихся со сладким вкусом и 25% иных цветов. Для образования формы объектов в композиции вспомните свои ощущения от поедания сладкого, вплоть до приторно-сладкого. Сразу на ум приходят мягкие лекальные кривые, тягучие, каплеобразные формы, могут возникать ассоциации с выдавливающимися джемами, со стекающими кремовыми прослойками между многослойными коржами. Просто надо начать анализировать и преобразовывать собственные воспоминания в отвлеченные от предметов линии и цвета.
Рис. 6. Примеры выражения в абстрактной лирической композиции кислых и сладких ощущений а) в черно-белой графике, б) в цвете. Иконникова Е.
Как выразить радость и грусть в композиции
Грусть в рисунке — это темные, густые ахроматические или стремящиеся к ахроматическим краски, некая обезличенность или скука выраженная однообразными формами и одинаковыми расстояниями между ними, вертикальные ритмы, лекальные кривые, создание эффекта «дымки», туманности специальными приёмами, например пуантелью. Радость – это динамичная композиция, ассиметричная, ритмы постоянно меняются, как и масштабы. Все элементы выполняют свою работу: средние формы по отношению к формату, как правило, несут основную смысловую нагрузку и создают основное действие, у крупных элементов в композиции есть свойство объединять средние в систему, соподчинять разрозненные элементы, мелкие являются «изюмом» каждой композиции. Продуманными пластическими фразами они украшают композицию, подобно маленьким украшением в гардеробе. Опять же вспоминайте атрибуты праздника и компонуйте линии точки похожие на фейерверк, дождик, конфетти, ленты, хлопки, вспышки и т.д. Цвета соответственно должны быть открытые яркие .
Рис. 7. Примеры изображения в абстрактной композиции а) тактильных, б) тактильных, в) слуховых и иных ощущений. Иконникова Е.
Общие рекомендации чуть-чуть всё стараться гиперболизировать, чтобы не оставлять зрителю шанса нафантазировать себе что-либо иное.
Мы проделали огромную работу, которую практически невозможно сделать отлично в связи с индивидуальным восприятием. Мы не касались культурологических, религиозных и социальных ассоциаций людей, только физических и физиологических – общих, пожалуй, для всего населения земного шара. Здесь важнее было даже представить метод рассуждений, который в дальнейшем можно применять к таким задачам, как выразить тепло и холод, звонкость и глухость, агрессию или миролюбие, возбуждение и спокойствие и т. д. В статье затронуты важные моменты композиционных знаний, т. к. в обучении профессиям архитектурно-художественного цикла задания на выражение ощущений в абстракции есть, но факта наличия чёткой опорной теории автор не знает. Поэтому была произведена попытка дать базис из личных наработок автора для индивидуальных размышлений, для поиска авторских приёмов начинающих художников. Обратим внимание читателя на то, что в статье приведены базовые принципы, которые наверняка понятны профессионалам со стажем и аналитическим мышлением. А так как один из принципов композиции новизна (не в том смысле, что любая авторская разработка, которая ранее не существовала сама по себе новая, а в том смысле, что она композиция должна кардинально выделяться индивидуальными находками из однообразной массы), то к этому базису каждому автору необходимо искать свои индивидуальные наработки. Осталось сказать, что представленная авторская концепция не истина в последней инстанции, учитесь на собственном опыте, анализируйте, синтезируйте. Прислушиваться к внутреннему голосу, как ни странно, очень важно, как важно и анализировать данный себе же ответ и пытаться понять, как исправить то, что не нравится, или как не испортить то, что нравится. Так приёмы и находки связанные с положительным ответом с годами слежаться в огромный профессиональный багаж, который также очиститься и от неудачных проб, связанных с отрицательными личными переживаниями и отзывами педагогов.
А.С. Чувашов
Список литературы:
1. Крючкова В. А. Абстракционизм // Большая российская энциклопедия / С. Л. Кравец. Москва: Большая Российская энциклопедия, 2005. Т. 1. С. 42-43. 768 с.
2. Саруханян А. П. К соотношению понятий «модернизм» и «авангардизм» // Авангард в культуре ХХ века (1900—1930 гг.): Теория. История. Поэтика: В 2 кн. / Под ред. Ю. Н. Гирина. — М.: ИМЛИ РАН, 2010. — Т. 1. — С. 23.
со своего сайта.
Равновесная композиция— обзор
В этой главе приведены примеры моделирования ситуаций, когда минимизация энтропии дает решение, соответствующее реальному поведению системы, и были примеры, когда максимизация дает соответствующие решения. Примеры включают кинетические системы (поток жидкости, теплопередача), равновесные системы и системы, в которых важны как кинетика, так и равновесие. Эти примеры изучались или пересматривались с целью получить представление о более широкой цели — нахождении общего принципа экстремизации для термодинамики.
7.1 Обсуждение
Примечание, относящееся к сделанным нами выводам: хотя мы ссылаемся на них в некоторых обсуждениях, эта глава не содержала математических результатов для переходных процессов — инерционных или неинерциальных. Наши результаты были либо для устойчивых потоков (в категориях a, c и d), либо для равновесных состояний (категория b), без учета кинетики — темпов времени — процесса, ведущего к равновесию.
Относится к категориям (a) и (b): Как хорошо известно, скорость производства энтропии для каждого скоростного процесса пропорциональна произведению скорости потока (или «реакции») на связанную термодинамическую движущую «движущую силу». ‘.По мере развития необратимого переходного процесса движущая сила непрерывно уменьшается, и, следовательно, для неинерционных переходных процессов, так же как и скорость производства энтропии — от начального максимального значения. Поскольку скорость производства энтропии непрерывно снижается, она должна идти до минимальной скорости. Когда он может перейти к самому низкому возможному значению, нулю, достигается стабильное состояние равновесия. При наложении устойчивых граничных условий система не может достичь нулевого предела, скорость уменьшения производства энтропии переходит к минимальной скорости, совместимой с граничными условиями (и остается постоянной).
Очевидно, важно заметить основное различие между категориями (a) и (d). В каждом случае Категории (а) экстремизация скорости производства энтропии использовалась для получения решения математической модели, моделирующей процесс. То есть неполная математическая модель была дополнена использованием вместо некоторого «стандартного» предположения уравнения баланса энтропии с последующим экстремальным увеличением скорости производства энтропии. В двух случаях категории (d) производство энтропии было рассчитано на основе существующих решений для полной базовой математической модели, не имеющей допущений (какими бы правдоподобными) они ни были.Основные уравнения для несжимаемого потока в трубопроводах должны иметь более одного решения. Потому что, по крайней мере, при некоторых рабочих условиях, экспериментально видно несколько решений, а именно наблюдается как ламинарный, так и турбулентный поток. Для ламинарных течений легко получить аналитическое решение, но, конечно, не для турбулентных течений. Решение engineering , которое мы использовали для турбулентного потока, конечно, не аналитическое, а эмпирическое, т.е. из экспериментов (и, следовательно, возможно, на больше, чем на реальных, чем аналитическое решение, которое, в любом случае, требует эмпирически определенной вязкости).Экспериментальные результаты представлены, подогнаны, давним уравнением Коулбрука.
Но если минимизация скорости производства энтропии дает хорошие решения для Категории (a), разве мы не ожидаем (надеемся?), Что ситуация будет одинаковой для и случаев, рассматриваемых в Категории (d)? Все, что мы можем сказать на данный момент:
- •
Существует фундаментальная разница: использование скорости производства энтропии для дает решения в Категории (a) и использование существующих решений для вычислить и сравнить скорость производства энтропии в Категории (d).
- •
В самом деле, как упоминалось выше, если скорость производства энтропии минимизирована (или максимизирована), когда скорость потока является результатом указанного падения давления, то математически она должна быть максимизирована (или минимизирована), когда возникает падение давления. от указанного расхода.
Тем не менее, мы можем спросить: «Есть ли что-то общее между случаями в категории (а) и случаем заданного падения давления в категории (d)?» Или, что более вероятно, между категориями (b) и (d)? В конце концов, процесс перехода от ламинарного к турбулентному потоку (и наоборот) — это процесс «уравновешивания», т.е.е. процесс, ведущий к стабильной (т. е. постоянной) конфигурации при наложенных ограничениях. Например, если бы мы могли смоделировать переходный процесс, наблюдали бы мы прогрессивное увеличение производства энтропии на единицу массы? (И до максимального, предельного значения?) Такое постепенное увеличение согласуется с наблюдениями, которые мы сделали для случая указанного расхода.
Более того, не противоречит результатам для случая заданного падения давления; как указывалось ранее, когда указан перепад давления, это определяет производство энтропии на единицу массы.Кажется разумным предположить, что, когда производство энтропии определено, подходящим «двойным» критерием было бы экстремальное значение доступной энергии — возможно, минимизация содержания доступной энергии .
7.2 Завершение
Интересно, что нередко можно услышать утверждение: «Второй закон является особенным среди законов физики, поскольку он не говорит, что должно произойти , а только накладывает ограничения на то, что происходит». Итак, — это странно — странно! Мы считаем, что поиск общего «уравнения движения» — это поиск формулировки Второго закона, который скажет, что должно произойти с .
Более того, такое уравнение движения вполне могло оказаться принципом экстремума, возможно, сродни принципу Гамильтона. Следует отметить, что много лет назад Гельмгольц [12] предложил такой принцип для частного случая; см. Ref. [13] например.
В любом случае, есть надежда, что исследования, представленные в этой главе, внесут вклад в разработку обобщенного Второго закона. Авторы полагают, что вполне вероятно, что обобщение будет сформулировано в терминах концепции доступной энергии, предложенной Гиббсом (см.[3,14,15]).
Номенклатура
- A
площадь
- c
удельная теплоемкость
- D
диаметр
- E энергия 0003 energy 900 энергия
- f
Коэффициент трения вентилятора
- k
Постоянная Больцмана
- L
длина
- M
Маха
масса; или, статистическая сумма
- N
число молей, число частиц
- p
давление; или, вероятность
- Q , q
теплопередача, теплопередача на единицу массы
- R
постоянная идеального газа
- Re
Число Рейнольдса
- S , s
энтропия, удельная энтропия
- T
температура
- U, u
внутренняя энергия, удельная внутренняя энергия
- 3 V 9022
скалярная скорость
- V , v
объем, удельный объем
- x
массовая доля; или, степень реакции
Греческие переменные
- Χ
мольная доля
- γ
c p / c v
0
- 4 6 μ
0 вязкость
- ρ
плотность
- σ
производство безразмерной энтропии
- σ *
альтернативное безразмерное производство энтропии
производство
застой
вход или начальный
горловина
выход или конечный
9007 до шока
yпосле удара
900 46Состав равновесной смеси
- Последнее обновление
- Сохранить как PDF
- Авторы и авторства
Студенты часто задаются вопросом, почему многие химические реакции приводят к равновесной смеси, в которой присутствует значительное количество реагентов, даже если продукты имеют более низкую стандартную свободную энергию, чем реагенты.Сначала можно было подумать, что до тех пор, пока присутствует любых реагентов, свободная энергия может быть уменьшена, если преобразование реагентов в продукты было полным.
Короткий ответ заключается в том, что за счет «загрязнения» некоторых продуктов реагентами свободная энергия системы (включая как реагенты, так и продукты) может быть снижена ниже, чем у чистых продуктов. Это дополнительное падение свободной энергии связано с свободной энергии смешения реагентов с продуктами.
Если вы не записаны на более продвинутый курс, от вас, вероятно, не ожидается, что вы будете знать, как рассчитывать свободную энергию смешения. Все, что вам действительно нужно знать, это то, что формально это эквивалентно расширению газов (или растворению растворенного вещества) в большем объеме. Подробнее см. Здесь.
Этот пример иллюстрирует, как свободная энергия компонентов реакции сочетается со свободной энергией смешивания реагентов с продуктами, чтобы минимизировать функцию Гиббса в равновесной смеси.Чтобы упростить задачу, мы будем иметь дело с равновесием изомеризации между двумя бутанами C 4 H 10 при 298 K:
| n -бутан | изо -бутан | |
| S °, Дж моль –1 | 310 | 295 |
| Δ G f °, кДж моль –1 | .97
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Глава 9 Химическое равновесие
Химические реакции движутся к динамическому равновесию, в котором оба реагенты и продукты присутствуют, но не претерпевают чистых изменений. Направление «спонтанного» изменения — в сторону меньших значений энергии Гиббса, G .
9,1 Минимум энергии Гиббса
Равновесный состав реакционной смеси определяем по вычисление энергии Гиббса реакционной смеси и определение состав, соответствующий минимум G .
(а) Энергия Гиббса реакции
Рассмотрим . Предположим, что бесконечно малое количество dx A превращается в B, Тогда изменение количества присутствующего A будет dn A = -dx а изменение количества B составляет dn B = + dx
Величина x называется степенью реакции ; это
имеет размеры количества вещества и выражается в молях.Когда степень реакции меняется на
конечное количество Dx, количество A в настоящем изменяется с n A к n A, 0 — Dx
а количество B меняется от
от n B до n B, 0 + Dx.
Реакция Энергия Гиббса, D r G , это определяется как наклон графика энергии Гиббса в зависимости от степени реакция:
Обычно D означает разницу, но в данном случае D r означает производную, наклон G по x.
Таким образом, D r G может быть интерпретируется как разница между химическими потенциалами реагентов и продуктов в составе реакционной смеси.
Поскольку химические потенциалы меняются в зависимости от состава, наклон G на фоне меняется и степень реакции. Для A B реакция является самопроизвольным, когда m A > m B .
Наклон равен нулю, реакция спонтанная в ни в одном направлении, когда D r G = 0.
(б) Экзергонические и эндергонические реакции
Если D r G <0, то
прямая реакция спонтанна. экзергонический
Если D r G > 0, обратная реакция является спонтанной. эндергоник
Если D r G = 0, реакция находится в равновесии.(ни exer-, ни
эндергоник)
(c) Идеальное газовое равновесие
Когда A и B — идеальные газы, мы можем написать
Если обозначить отношение парциальных давлений через Q, получим
Отношение Q определяется как коэффициент реакции . Это диапазоны от 0 (чистый A) до бесконечности (чистый B). Энергия Гиббса стандартной реакции, D r G определяется как разность стандартных молярных энергий Гиббса продуктов и реагенты.
Мы знаем, что разница в стандартных молярах Гиббса энергии продуктов и реагентов равна разнице их стандартные энергии Гиббса образования, таким образом,
В состоянии равновесия D r G = 0 и отношение парциальных давлений обозначается как K
Молекулярная интерпретация 9.1
С молекулярной точки зрения, минимум энергии Гиббса, который соответствует D r G = 0, происходит от энергия смешения двух газов. Важный вклад в положение химического равновесия вносит смешивание продуктов с реагентами по мере их образования.
Мы видим, что при D r G > 0, K <1.Тогда в состоянии равновесия парциальное давление A превышает парциальное давление B, это означает, что реагент A находится в равновесии. Когда D r G <0, K > 1 и B предпочтение равновесие.
(г) Общая реакция
В общем случае изменение количества любого вида J равно n J Dx, где n J — величина стехиометрическое число J в химическом уравнении.
Символ P для обозначения умножение продукта. Каждый вид в степени, заданной его стехиометрическим коэффициентом, n.
Напомним, что для чистых твердых тел и жидкостей, активность 1 , поэтому нет вклада в Q, даже если они могут появиться в химическом уравнение.Для газа a Дж = f Дж / p 0 , где f Дж — его летучесть. Для идеального газа f Дж = p Дж частичное давление J.
Рассмотрим реакцию 2A + 3B C + 2D
В состоянии равновесия наклон G равен нулю: D r G = 0, и деятельности имеют свои равновесные значения, поэтому
Эти выражения имеют ту же форму, что и Q , но вычисляются с использованием равновесных действий.An константа равновесия K , выраженная в единицах активности (или летучести) называется константой термодинамического равновесия . Обратите внимание, что, поскольку действия представляют собой безразмерные числа, константа термодинамического равновесия также безразмерна. Мы часто можем приблизить действия с концентрации и летучести с парциальными давлениями.
(e) Связь между константами равновесия
Для выражения констант равновесия через мольные доли x Дж или молярности b Дж частиц нам нужно знать коэффициенты активности.Напомним
Например,
Коэффициенты активности должны оцениваться при равновесии состав смеси, который может потребовать сложного расчета, потому что последнее известно только в том случае, если известен равновесный состав.В элементарных приложениях мы обычно предполагаем К г = 1. Таким образом, K приблизительно равно = K b . В главе 10 мы покажем, как электрохимия может быть использована для оценки коэффициентов активности.
Молекулярная интерпретация констант равновесия
Рассмотрим молекулы реагента A на уровнях энергии, доступных для молекула. В большой группе (например, моль 10 23 молекул) статистическое распределение Больцмана молекул над доступными состояниями показывает большую популяцию (количество) молекулы при более низких энергиях, уменьшаясь по мере того, как энергия уровня увеличивается.
При данной температуре будет определенное распределение популяции, а значит, и особый состав реакционной смеси.
На следующем рисунке, хотя уровни энергии B все еще лежат выше, чем уровни энергии A, в этом случае они намного ближе разнесены.В результате их общая популяция может быть значительной, и B может даже доминировать в реакции смесь в состоянии равновесия. Близко расположенные уровни энергии коррелируют с высокой энтропией, поэтому в этом случае мы видим, что энтропия эффекты могут отменять положительную энтальпию. Положительная энтальпия приводит к понижению константы равновесия
однако большая положительная энтропия может способствовать смещению равновесия. к продуктам реакции, несмотря на эндотермический характер реакция.
Примеры близко расположенных уровней энергии включают нежесткие молекулы. Несколько конформаций доступны с очень небольшим количеством энергии, необходимой для взаимного преобразования.Это источник близко расположенных энергетических уровней. Например, рассмотрим этилен, H 2 C = CH 2 имеет один конфигурация, в то время как этан, H 3 C-CH 3 имеет три вращающихся изомеры с эквивалентной энергией. Выше энтропия и более близкие уровни энергии ожидаются для этана.
Константа равновесия для катализируемых изменений реакции скорость реакции, при которой достигается равновесие, но не влияет на положение равновесия.
9.2 Как равновесие реагирует на давление
Константа равновесия зависит от значения D r G, которое определяется для одного стандартное давление. Следовательно, D r G и K не зависят от давления , при котором фактически наступает равновесие. учредил. Формально
Хотя K не зависит от давления, равновесие состав может меняться.Там два способа увеличить давление реакции:
1. Добавить инертный газ Если газ ведет себя идеально, парциальное давление продуктов и реагенты не меняются, следовательно, равновесный состав остается прежним.
2. C сжатие Давление в системе может можно увеличить за счет ограничения газов в меньшем объеме. В этом случае парциальные давления будут изменять.Рассмотрим случай A 2B,
.Чтобы оставаться постоянным, увеличение p A должно компенсировать увеличение квадрата из p B . Количество молекул А увеличится.
Увеличение числа молекул A и соответствующих уменьшение количества молекул B, вызванное сжатием, является особым случай принципа ЛеШелье.
Система в состоянии равновесия, когда подвергается возмущению, реагирует таким образом, чтобы свести к минимуму влияние помех.
Например, сжатие предыдущего случая: система попытается чтобы минимизировать количество частиц в газовой фазе, A 2B.
Степень диссоциации a, A на B равна обратно пропорционально давлению. As p увеличивается а уменьшается.
В
в общем, состав будет сдвигаться в сторону реакции с меньшим количеством
молей в газовой фазе.
Иллюстрация
Предсказать влияние увеличения давления на состава синтеза аммиака при равновесии, отметим, что количество газа молекул уменьшается (с 4 до 2). Так Принцип Ле-Шателье предсказывает, что увеличение давления будет благоприятствовать продукту.
9.3 Реакция равновесия на температуру
LeChatelier’s принцип предсказывает, что система в состоянии равновесия будет иметь тенденцию сдвигаться в эндотермическое направление, если температура повышается, тогда энергия поглощается как тепло. И наоборот, равновесие может ожидается смещение в экзотермическом направлении при понижении температуры, для понижения температуры против.
Экзотермические реакции:
Повышенная температура благоприятствует реагенты.
Эндотермические реакции:
Повышенная температура благоприятствует товары.
(a) Уравнение Вант-Гоффа
Выражение наклона графика константы равновесия как функция температуры.
Обоснование 9.3
Дифференциалы в сборе, потому что K и D r G 0 зависят только от Т, а не р. Из уравнения Гиббса-Гельмгольца
Форма b получается записью
Когда реакция экзотермическая в стандартных условиях
(D r H <0) .
Отрицательный наклон означает, что ln K , и, следовательно, K сам по себе уменьшается с повышением температуры.
Некоторое представление о термодинамическом поведении можно найти в выражение
Когда реакция экзотермическая, -D H / T соответствует положительное изменение энтропии окружающей среды и способствует образованию товары.Когда T увеличивается, -D H / T уменьшается, и возрастающая энтропия окружающей среды играет менее важную роль. В результате равновесие находится в меньшей степени Правильно.
Когда реакция эндотермическая, основным фактором является увеличение энтропии реакционной системы.Важность неблагоприятного изменения энтропии окружающая среда уменьшается, если температура повышается (потому что D H / T меньше), и реакция может переходить в сторону продуктов.
(б) Значение К при разных температурах.
Интегрируем, получаем
Если предположить, что энтальпия реакции постоянна в зависимости от температуры диапазон интересов, то у нас
Иллюстрация
Для оценки константы равновесия при синтезе аммиака при 500 К от его значения при 298 К (6.0 x 10 5) используем стандартная энтальпия реакции (Таблица 2.6), (D f H = 0 для H 2 и N 2 .) Затем с D r H = -92,2 кДж / моль, находим
Кислотно-основные равновесия в воде
Единственное изменение — использование активности вместо концентрации в выражение равновесия.
Для разбавленного раствора активность воды близка к 1 (значение чистой воды), а равновесие можно выразить через кислотность постоянная, K a :
РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ C / H ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ (Технический отчет)
Дафф, Р. Э., и Бауэр, С. Х. РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ C / H ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ . США: Н. П., 1961.
Интернет.
Duff, R. E., & Bauer, S. H. РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ C / H ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ . Соединенные Штаты.
Дафф, Р. Э., и Бауэр, С. Х.Чт.
«РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ C / H ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ». Соединенные Штаты.
@article {osti_4843104,
title = {РАВНОВЕСНЫЙ СОСТАВ СИСТЕМЫ C / H ПРИ ПОВЫШЕННЫХ ТЕМПЕРАТУРАХ},
author = {Дафф, Р. Э. и Бауэр, С. Х.},
abstractNote = {Термодинамические функции для большого количества молекул C-H были рассчитаны на основе оценочных значений молекулярных параметров.Эти и другие функции, взятые из литературы, были использованы для расчета равновесного состава газофазной системы C / H в диапазоне составов C / H = 1/10, 1/4, 1/2, 1, 2, 3. диапазон температур составлял от 500 до 5000 градусов К, а использованное давление составляло 0,1, 1-0 и 10 атин. В дополнительных расчетах предполагалось присутствие твердого углерода. Представлены графики результатов. Они показывают, что знакомые стабильные углеводороды не важны для характеристики равновесного состава при температурах выше 2000 градусов К.Молекулы ацетилена и их радикалы преобладают в составе при высоких температурах. (auth)},
doi = {},
url = {https://www.osti.gov/biblio/4843104},
журнал = {},
номер =,
объем =,
place = {United States},
год = {1961},
месяц = {6}
}
(PDF) Расчет химического равновесного состава воздуха до 30000K
23
СПИСОК ЛИТЕРАТУРЫ
Anderson Jr., J. D., 1989, «Hypersonic and High Temperature Gas Dynamics», Series in
Aeronautical and Aerospace Engineering, Ed. МакГроу-Хилл, Сингапур, 690 стр.
Карвалью-младший, Дж. А. С., МакКуэй, М. К., 2007, «Princípios de Combustão Aplicada», под ред. Федеральный
Университет Санта-Катарины, Флорианополис, Бразилия, 175 стр.
Гордон С., Макбрайд Б. Дж., 1994, «Компьютерная программа для расчета сложных химических
равновесных составов и приложений», справочная публикация НАСА 1311.
Гупта, Р.Н., Йос, Дж. М., Томпсон, Р.А., и Ли, К.П., 1990, » Обзор скоростей реакций
и термодинамических и транспортных свойств для модели воздуха с 11 видами для химических
и расчетов термической неравновесности до 30000 K », справочная публикация NASA
1232.
Meintjes, K., Morgan, AP, 1989, «Элементы-переменные и решение сложных химических проблем
равновесия», Combustion Science and Technology, Vol.68, с. 35-48.
Пинто, Дж. К., Лаге, П. Л. С., 2001, «Método Numéricos em Problemas de Engenharia Química»,
Série Escola Piloto em Engenharia Química COOPE / Federal University of Rio de Janeiro,
Ed. Электронные газеты, Рио-де-Жанейро, Бразилия, 316 стр.
Прабху, Р., Эриксон, В.Д., 1988, «Быстрый метод расчета равновесия
Химический состав воздуха до 15000 К», Технический документ НАСА 2792.
Сабетта, Ф., Фавини, Б. .и Онофри М., 1993, «Равновесное и неравновесное моделирование
гиперзвуковых невязких потоков», Computers Fluids, Vol. 22, No. 2/3, pp. 369-380.
Смит, Г. Л., Эриксон, В. Д., Иствуд, М. Р., 1967, «Уравнения для быстрой машины
Расчет равновесного состава воздуха и производные для расчетов поля потока
», Техническая записка НАСА D-4103.
William, J., 2000, ‘‘ ‘‘ Etude des Processus Physico-Chimiques dans les Écoulements Détendus à
Haute Enthalpie: Application à la Soufflerie à Arc F4 ’’, ONERA NT 2000-5, Vol.I и II.
Факторы, влияющие на равновесие
15.5 Факторы, влияющие на равновесие
Цель обучения
- Для прогнозирования воздействия напряжений на систему в состоянии равновесия.
Химики используют различные стратегии для увеличения выхода желаемых продуктов реакций. Например, при синтезе сложного эфира, как химик может контролировать условия реакции, чтобы получить максимальное количество желаемого продукта? Только три типа напряжений могут изменить состав равновесной смеси: (1) изменение концентраций (или парциальных давлений) компонентов путем добавления или удаления реагентов или продуктов, (2) изменение общего давления или объема, и (3) изменение температуры системы.В этом разделе мы исследуем, как изменения условий реакции могут повлиять на равновесный состав системы. Мы рассмотрим каждую из этих возможностей по очереди.
Изменения концентрации
Если мы добавим небольшой объем растворителя четыреххлористый углерод (CCl 4 ) в колбу, содержащую кристаллы йода, мы получим насыщенный раствор I 2 в CCl 4 вместе с нерастворенными кристаллами:
Уравнение 15.33
I2 (s) ⇌растворитель I2 (soln)Система достигает равновесия с K = [I 2 ]. Если мы добавим еще CCl 4 , тем самым разбавив раствор, Q теперь будет меньше K . Принцип Ле Шателье говорит нам, что система отреагирует на снятие стресса, но как? Добавление растворителя усиливает систему, уменьшая концентрацию растворенного I 2 . Следовательно, будет растворяться больше кристаллов, тем самым увеличивая концентрацию растворенного I 2 до тех пор, пока система снова не достигнет равновесия, если имеется достаточно твердого I 2 (Рисунок 15.10 «Концентрация растворенного I»). Добавляя растворитель, мы направили реакцию, показанную в уравнении 15.33 вправо, как написано.
Рисунок 15.10 Концентрация растворенного I 2 как функция времени после добавления большего количества растворителя к насыщенному раствору, контактирующему с избытком твердого вещества I 2
Концентрация I 2 сначала уменьшается из-за разбавления, но возвращается к исходному значению, пока присутствует твердый I 2 .
Мы встречаем более сложную систему в реакции водорода и азота с образованием аммиака:
Уравнение 15.34
N2 (г) + 3h3 (г) ⇌2Nh4 (г)K p для этой реакции составляет 2,14 × 10 −2 при примерно 540 К. В одном наборе условий равновесия парциальное давление аммиака PNh4 = 0,454 атм, парциальное давление водорода Ph3 = 2,319 атм. , а азота PN2 = 0.773 атм. Если в реактор добавить еще 1 атм водорода, чтобы получить Ph3 = 3,319 атм, как отреагирует система? Поскольку напряжение представляет собой увеличение Ph3, система должна каким-то образом реагировать, уменьшая парциальное давление водорода, чтобы противодействовать напряжению. Таким образом, реакция будет идти вправо, как написано, потребляя H 2 и N 2 и образуя дополнительный NH 3 . Первоначально парциальные давления H 2 и N 2 будут уменьшаться, а парциальное давление NH 3 будет увеличиваться до тех пор, пока система в конечном итоге не достигнет нового равновесного состава, что приведет к чистому увеличению Ph3.
Мы можем подтвердить, что это действительно произойдет, оценив Q p в новых условиях и сравнив его значение с K p . Уравнения, используемые для оценки K p и Q p , имеют одинаковую форму: подставляя значения после добавления водорода в выражение для Q p , получаем следующее:
Qp = (PNh4) 2 (PN2) (Ph3) 3 = (0.454) 2 (0,773) (2,319 + 1,00) 3 = 7,29 × 10−3Таким образом, Q p < K p , что говорит нам о том, что отношение продуктов к реагентам меньше, чем в состоянии равновесия. Чтобы достичь равновесия, реакция должна идти вправо, как написано: парциальные давления продуктов увеличиваются, а парциальные давления реагентов уменьшаются. Q p , таким образом, увеличится до K p , и система снова окажется в равновесии.Изменения парциальных давлений различных веществ в реакционной смеси (уравнение 15.34) как функция времени показаны на рисунке 15.11 «Парциальные давления H».
Рисунок 15.11 Парциальные давления H 2 , N 2 и NH 3 как функция времени после добавления большего количества H 2 к равновесной смеси
Часть добавленного водорода расходуется на реакцию с азотом с образованием большего количества аммиака, позволяя системе достичь нового равновесного состава.
Мы можем заставить реакцию идти по существу до завершения, независимо от величины K , непрерывно удаляя один из продуктов из реакционной смеси. Рассмотрим, например, реакцию метанирования , в которой водород реагирует с монооксидом углерода с образованием метана и воды:
Уравнение 15.35
CO (г) + 3h3 (г) ⇌Ch5 (г) + h3O (г)Эта реакция используется для промышленного производства метана, тогда как обратная реакция используется для получения H 2 (Пример 14).Выражение для Q имеет следующий вид:
Уравнение 15.36
Q = [Ch5] [h3O] [CO] [h3] 3Независимо от величины K , если из реакционной смеси можно удалить либо H 2 O, либо CH 4 , так что [H 2 O] или [CH 4 ] будет приблизительно равным нулю, тогда Q ≈ 0. Другими словами, когда продукт удаляется, система подвергается нагрузке ( Q << K ), и образуется больше продукта, чтобы противостоять нагрузке.Поскольку вода (точка кипения = 100 ° C) намного менее летучая, чем метан, водород или монооксид углерода (все из которых имеют точки кипения ниже -100 ° C), прохождение газовой реакционной смеси через холодный змеевик приведет к тому, что водяной пар будет испаряться. конденсируются в жидкость, которую можно слить. Продолжая удалять воду из системы, реакция движется вправо, поскольку система пытается уравновеситься, тем самым обогащая реакционную смесь метаном. Этот метод, называемый , управляющий реакцией на завершение , может использоваться для принудительной реакции на завершение, даже если K относительно мало.Например, сложные эфиры обычно синтезируют путем удаления воды. Здесь показаны продукты реакции конденсации. В главе 19 «Электрохимия» мы опишем термодинамические основы изменения положения равновесия, вызванного изменениями концентраций компонентов реакции.
Пример 16
Для каждой равновесной системы спрогнозируйте влияние указанного напряжения на указанное количество.
- 2SO2 (г) + O2 (г) 2SO3 (г): (1) влияние удаления O 2 на PSO2; (2) эффект удаления O 2 на PSO3
- CaCO3 (s) ⇌CaO (s) + CO2 (г): (1) влияние удаления CO 2 на количество CaCO 3 ; (2) влияние добавления CaCO 3 на PCO2
Дано: сбалансированные химические уравнения и изменения
Запрошено: эффекты указанных напряжений
Стратегия:
Используйте Q и K , чтобы предсказать влияние стресса на каждую реакцию.
Решение:
- (1) Удаление O 2 снизит PO2, тем самым уменьшив знаменатель в коэффициенте реакции и сделав Q p > K p . Реакция будет идти влево, как написано, увеличивая парциальные давления SO 2 и O 2 до тех пор, пока Q p снова не станет равным K p .(2) Удаление O 2 снизит PO2 и, таким образом, увеличит Q p , поэтому реакция пойдет влево. Парциальное давление SO 3 снизится.
- K p и Q p оба равны PCO2. (1) Удаление CO 2 из системы заставляет большее количество CaCO 3 реагировать с образованием CO 2 , что увеличивает парциальное давление PCO2, требуемое для K p .(2) Добавление (или удаление) твердого CaCO 3 не влияет на PCO2, потому что он не появляется в выражении для K p (или Q p ).
Упражнение
Для каждой равновесной системы спрогнозируйте влияние, которое указанное напряжение окажет на указанную величину.
- h3 (г) + CO2 (г) ⇌h3O (г) + CO (г): (1) влияние добавления CO на [H 2 ]; (2) влияние добавления CO 2 на [H 2 ]
- CuO (s) + CO (г) ⇌Cu (s) + CO2 (г): (1) влияние добавления CO на количество Cu; (2) влияние добавления CO 2 на [CO]
Ответ:
- (1) [H 2 ] увеличивается; (2) [H 2 ] уменьшается.
- (1) количество Cu увеличивается; (2) [CO] увеличивается.
Изменения общего давления или объема
Поскольку жидкости относительно несжимаемы, изменение давления над жидким раствором мало влияет на концентрацию растворенных веществ. Следовательно, изменения внешнего давления очень мало влияют на равновесные системы, которые содержат только твердые тела или жидкости. Напротив, поскольку газы обладают высокой сжимаемостью, их концентрации сильно зависят от давления.Из закона идеального газа, PV = nRT , описанного в главе 11 «Жидкости», концентрация ( C ) газа связана с его давлением следующим образом:
Следовательно, концентрация любого газообразного реагента или продукта прямо пропорциональна приложенному давлению ( P ) и обратно пропорциональна общему объему ( V ). Следовательно, равновесные составы систем, содержащих газообразные вещества, весьма чувствительны к изменениям давления, объема и температуры.
Эти принципы можно проиллюстрировать на примере обратимой диссоциации газообразного N 2 O 4 до газообразного NO 2 (уравнение 15.1). Шприц, показанный на рисунке 15.12 «Влияние изменения объема (и, следовательно, давления) равновесной смеси N», первоначально содержит равновесную смесь бесцветного N 2 O 4 и красно-коричневого NO 2 . Уменьшение объема на 50% приводит к потемнению смеси, поскольку все концентрации удвоились.Однако уменьшение объема также представляет собой стресс, как мы можем видеть, исследуя влияние изменения объема на Q . В состоянии равновесия Q = K = [NO 2 ] 2 / [N 2 O 4 ] (уравнение 15.13). Если объем уменьшается вдвое, концентрации веществ в смеси удваиваются, поэтому новый коэффициент реакции будет следующим:
Уравнение 15.38
Q = (2 [NO2] i) 22 [N2O4] i = 4 ([NO2] i) 22 [N2O4] i = 2KПоскольку Q теперь больше, чем K , система больше не находится в равновесии.Напряжение может быть снято, если реакция протекает влево, потребляя 2 моль NO 2 на каждый 1 моль полученного N 2 O 4 . Это снизит концентрацию NO 2 и увеличит концентрацию N 2 O 4 , в результате чего Q уменьшится до тех пор, пока оно снова не станет равным K . Таким образом, как показано в части (c) на Рисунке 15.12 «Эффект изменения объема (и, следовательно, давления) равновесной смеси N», интенсивность коричневого цвета из-за NO 2 уменьшается со временем после изменение громкости.
Рисунок 15.12 Влияние изменения объема (и, следовательно, давления) равновесной смеси N 2 O 4 и NO 2 при постоянной температуре
(a) Шприц общим объемом 15 мл содержит равновесную смесь N 2 O 4 и NO 2 ; красно-коричневый цвет пропорционален концентрации NO 2 . (b) Если объем быстро уменьшится в 2-7 раз.5 мл, первоначальный эффект заключается в удвоении концентраций всех присутствующих веществ, включая NO 2 . Следовательно, цвет становится более интенсивным. (c) Со временем система корректирует свой состав в ответ на стресс, как предсказано принципом Ле Шателье, образуя бесцветный N 2 O 4 за счет красно-коричневого NO 2 , что снижает интенсивность цвет смеси.
Обратите внимание на узор
Повышение давления в системе (или уменьшение объема) благоприятствует той стороне реакции, которая имеет меньшее количество газообразных молекул, и наоборот.
Как правило, , если сбалансированное химическое уравнение содержит разное количество газообразных реагентов и молекул продукта, равновесие будет чувствительно к изменениям объема или давления . Увеличение давления в системе (или уменьшение объема) будет способствовать той стороне реакции, которая имеет меньше газообразных молекул, и наоборот.
Пример 17
Для каждой равновесной системы запишите коэффициент реакции системы, если давление уменьшится в 2 раза (т.е.е., если объем увеличен вдвое) при постоянной температуре, а затем предсказать направление реакции.
- N2 (г) + 3h3 (г) ⇌2Nh4 (г)
- C2h3 (г) + C2H6 (г) ⇌2C2h5 (г)
- 2NO2 (г) ⇌2NO (г) + O2 (г)
Дано: сбалансированные химические уравнения
Запрашивается: направление реакции при уменьшении давления вдвое
Стратегия:
Используйте принцип Ле Шателье, чтобы предсказать эффект стресса.
Решение:
Два моля газообразных продуктов образуются из 4 моль газообразных реагентов. Уменьшение давления вызовет смещение реакции влево, поскольку на этой стороне находится большее количество молей газа. Таким образом давление увеличивается, противодействуя стрессу. K для этой реакции составляет [NH 3 ] 2 / [N 2 ] [H 2 ] 3 .Когда давление уменьшается в 2 раза, концентрации уменьшаются вдвое, что означает, что новый коэффициент реакции составляет:
Q = [1 / 2Nh4] 2 [1 / 2N2] [1 / 2h3] 3 = 1 / 4Nh421 / 16 [N2] [h3] 3 = 4K
Два моля газообразных продуктов образуются из 2 моль газообразных реагентов. Снижение давления не повлияет на равновесный состав, потому что обе стороны сбалансированного химического уравнения имеют одинаковое количество молей газа.Здесь K = [C 2 H 4 ] 2 / [C 2 H 2 ] [C 2 H 6 ]. Новый коэффициент реакции следующий:
Q = [C2h5] 2 [C2h3] [C2H6] = [1 / 2C2h5] 2 [1 / 2C2h3] [1 / 2C2H6] = 1/4 [C2h5] 21/4 [C2h3] [C2H6] = K
Три моля газообразных продуктов образуются из 2 моль газообразных реагентов.Уменьшение давления будет благоприятствовать той стороне, которая содержит больше молей газа, поэтому реакция сместится в сторону продуктов, чтобы увеличить давление. Для этой реакции K = [NO] 2 [O 2 ] / [NO 2 ] 2 . В новых условиях реакции коэффициент реакции следующий:
Q = [1 / 2NO] 2 [1 / 2O2] [1 / 2NO2] 2 = 1/8 [NO] 2 [O2] 1/4 [NO2] 2 = 1 / 2K
Упражнение
Для каждой равновесной системы запишите новый коэффициент реакции системы, если давление увеличится в 2 раза (т.е.е., если объем уменьшен вдвое) при постоянной температуре, а затем предсказать направление, в котором будет сдвигаться реакция.
- h3O (г) + CO (г) ⇌h3 (г) + CO2 (г)
- h3 (г) + C2h5 (г) ⇌C2H6 (г)
- 2SO2 (г) + O2 (г) ⇌2SO3 (г)
Ответ:
- Q = K ; нет эффекта
- Q = 1/2 K ; вправо
- Q = 1/2 K ; вправо
Изменения температуры
Во всех случаях, которые мы рассмотрели до сих пор, величина константы равновесия, K или K p , была постоянной.Однако изменения температуры могут изменить значение константы равновесия, не оказывая немедленного влияния на коэффициент реакции ( Q K ). В этом случае система больше не находится в равновесии; состав системы будет меняться до тех пор, пока Q не станет равным K при новой температуре.
Чтобы предсказать, как равновесная система будет реагировать на изменение температуры, мы должны знать кое-что об изменении энтальпии реакции (Δ H rxn ).Как вы узнали из главы 5 «Изменения энергии в химических реакциях», тепло выделяется в окружающую среду в результате экзотермической реакции (Δ H rxn <0), а тепло поглощается из окружающей среды в результате эндотермической реакции (Δ H rxn > 0). Мы можем выразить эти изменения следующим образом:
Уравнение 15.39
Экзотермический: реагенты-продукты + тепло (ΔH <0)Уравнение 15.40
Эндотермический: реагенты + теплопродукты (ΔH> 0)Таким образом, тепло можно рассматривать как продукт экзотермической реакции и как реагент в эндотермической реакции. Повышение температуры системы соответствует добавлению тепла. Принцип Ле Шателье предсказывает, что экзотермическая реакция сместится влево (в сторону реагентов), если температура системы повышается (добавляется тепло). И наоборот, эндотермическая реакция сместится вправо (в сторону продуктов), если температура системы повысится.Если реакция термохимически нейтральна (Δ H rxn = 0), то изменение температуры не повлияет на равновесный состав.
Мы можем изучить влияние температуры на диссоциацию N 2 O 4 до NO 2 , для которого Δ H = +58 кДж / моль. Эту реакцию можно записать так:
Уравнение 15.41
58 кДж + N2O4 (г) ⇌2NO2 (г)Повышение температуры (добавление тепла в систему) — это стресс, который будет направлять реакцию вправо, как показано на Рисунке 15.13 «Влияние температуры на равновесие между газообразным N». Таким образом, повышение температуры увеличивает отношение NO 2 к N 2 O 4 в состоянии равновесия, что увеличивает K .
Рисунок 15.13 Влияние температуры на равновесие между газообразным N 2 O 4 и NO 2
(в центре) Трубка, содержащая смесь N 2 O 4 и NO 2 в той же пропорции при комнатной температуре, имеет красно-коричневый цвет из-за присутствия NO 2 .(слева) Погружение трубки в ледяную воду приводит к тому, что смесь становится светлее из-за сдвига равновесного состава в сторону бесцветного N 2 O 4 . (справа) Напротив, погружение той же трубки в кипящую воду приводит к потемнению смеси из-за сдвига равновесного состава в сторону сильно окрашенного NO 2 .
Влияние повышения температуры на систему, находящуюся в состоянии равновесия, можно резюмировать следующим образом: повышение температуры увеличивает величину константы равновесия для эндотермической реакции, уменьшает константу равновесия для экзотермической реакции и не влияет на равновесие. константа термически нейтральной реакции .Таблица 15.3 «Температурная зависимость» показывает температурную зависимость констант равновесия для синтеза аммиака из водорода и азота, который представляет собой экзотермическую реакцию с Δ H ° = -91,8 кДж / моль. Значения как K , так и K p резко уменьшаются с повышением температуры, как и предсказывалось для экзотермической реакции.
Таблица 15.3 Температурная зависимость K и Kp для N2 (г) + 3h3 (г) ⇌2Nh4 (г)
| Температура (К) | К | К п. |
|---|---|---|
| 298 | 3.3 × 10 8 | 5,6 × 10 5 |
| 400 | 3,9 × 10 4 | 3,6 × 10 1 |
| 450 | 2,6 × 10 3 | 1,9 |
| 500 | 1.7 × 10 2 | 1,0 × 10 -1 |
| 550 | 2,6 × 10 1 | 1,3 × 10 −2 |
| 600 | 4,1 | 1,7 × 10 −3 |
Обратите внимание на узор
Повышение температуры вызывает эндотермические реакции в пользу продуктов и экзотермические реакции в пользу реагентов.
Пример 18
Для каждой равновесной реакции спрогнозируйте эффект снижения температуры:
- N2 (г) + 3h3 (г) ⇌2Nh4 (г) ΔHrxn = −91,8 кДж / моль
- CaCO3 (т) ⇌CaO (т) + CO2 (г) ΔHrxn = 178 кДж / моль
Дано: сбалансированные химические уравнения и значения Δ H rxn
Запрошено: эффекты понижения температуры
Стратегия:
Используйте принцип Ле Шателье, чтобы предсказать влияние понижения температуры на каждую реакцию.
Решение:
Образование NH 3 является экзотермическим, поэтому мы можем рассматривать тепло как один из продуктов:
N2 (г) + 3h3 (г) ⇌2Nh4 (г) +91,8 кДжЕсли температура смеси понижается, тепло (один из продуктов) удаляется из системы, что вызывает смещение равновесия вправо.Следовательно, образование аммиака благоприятствует при более низких температурах.
Разложение карбоната кальция эндотермическое, поэтому тепло можно рассматривать как один из реагентов:
CaCO3 (т) +178 кДж⇌CaO (т) + CO2 (г)Если температура смеси понижается, тепло (один из реагентов) удаляется из системы, что вызывает смещение равновесия влево.Следовательно, термическое разложение карбоната кальция менее благоприятно при более низких температурах.
Упражнение
Для каждой равновесной системы спрогнозируйте влияние повышения температуры на реакционную смесь:
- 2SO2 (г) + O2 (г) ⇌2SO3 (г) ΔHrxn = −198 кДж / моль
- N2 (г) + O2 (г) ⇌2NO (г) ΔHrxn = + 181 кДж / моль
Ответ:
- Реакция смещается влево.
- Реакция смещается вправо.
Сводка
Три типа напряжений могут изменить состав равновесной системы: добавление или удаление реагентов или продуктов, изменение общего давления или объема и изменение температуры системы. Реакцию с неблагоприятной константой равновесия можно довести до завершения, непрерывно удаляя один из продуктов реакции. Равновесия, которые содержат различное количество молекул газообразных реагентов и продуктов, чувствительны к изменениям объема или давления; более высокое давление благоприятствует стороне с меньшим количеством газообразных молекул.Отвод тепла от экзотермической реакции способствует образованию продуктов, тогда как отвод тепла от эндотермической реакции способствует образованию реагентов.
Key Takeaway
- На равновесие влияют изменения концентрации, общего давления или объема и температуры.
Концептуальные проблемы
Если равновесная реакция эндотермична в прямом направлении, каково ожидаемое изменение концентрации каждого компонента системы при повышении температуры реакции? Если температура снизилась?
Напишите уравнение равновесия для следующей системы:
4Nh4 (г) + 5O2 (г) ⇌4NO (г) + 6h3O (г)Ожидаете ли вы, что при повышении давления равновесие сместится в сторону продуктов или реагентов? Почему?
Скорость реакции увеличивается примерно вдвое на каждые 10 ° C повышения температуры.Что происходит с K ?
Образование A 2 B 2 (г) по равновесной реакции 2AB (г) ⇌A2B2 (г) является экзотермическим. Что произойдет с соотношением k f / k r при повышении температуры? Если повышаются и температура, и давление?
В каждой системе спрогнозируйте влияние, которое указанное изменение окажет на указанное количество в состоянии равновесия:
h3 (г) + I2 (г) ⇌2HI (г)
H 2 удалено; каково влияние на PI2?
2NOBr (г) ⇌2NO (г) + Br2 (г)
Br 2 удалено; каково влияние на P NOBr ?
2NaHCO3 (т) ⇌Na2CO3 (г) + CO2 (г) + h3O (г)
CO 2 удален; каково влияние на PNaHCO3?
Какое влияние окажет указанное изменение на указанное количество в состоянии равновесия?
Nh5Cl (т) ⇌Nh4 (г) + HCl (г)
NH 4 Cl повышен; каково влияние на P HCl ?
2h3O (г) ⇌2h3 (г) + O2 (г)
O 2 добавлен; как влияет на Ph3?
PCl3 (г) + Cl2 (г) ⇌PCl5 (г)
Cl 2 удален; каково влияние на PPCl5?
Числовые задачи
Для каждой равновесной реакции опишите, как Q и K изменяются при повышении давления, температуре, увеличении объема системы и увеличении концентрации (ей) реагента (ов).
- A (г) ⇌B (г) ΔH = −20,6 кДж / моль
- 2A (г) ⇌B (г) ΔH = 0,3 кДж / моль
- A (г) + B (г) ⇌2C (г) ΔH = 46 кДж / моль
Для каждой равновесной реакции опишите, как Q и K изменяются при понижении давления, повышении температуры, уменьшении объема системы и увеличении концентрации (ей) реагента (ов).
- 2A (г) ⇌B (г) ΔH = −80 кДж / моль
- A (г) ⇌2B (г) ΔH = 0,3 кДж / моль
- 2A (г) ⇌2B (г) + C (г) ΔH = 46 кДж / моль
Принцип Ле Шателье гласит, что система изменяет свой состав, чтобы противодействовать стрессу.Для системы CO (г) + Cl2 (г) COCl2 (г) запишите выражение для константы равновесия K p . Какие изменения в значениях Q и K вы ожидаете, когда (а) объем удвоится, (б) давление увеличится в 2 раза и (в) COCl 2 будет удален из система?
Для равновесной системы 3O2 (г) ⇌2O3 (г), Δ H ° = 284 кДж, запишите выражение константы равновесия K p .Что произойдет со значениями Q и K , если температура реакции повысится? Что произойдет с этими значениями, если и температура, и давление увеличатся?
Углерод и кислород реагируют с образованием газа CO 2 через C (s) + O2 (g) ⇌CO2 (g), для чего K = 1,2 × 10 69 . Ожидаете ли вы, что K увеличится или уменьшится, если объем системы утроится? Почему?
Реакция COCl2 (г) ⇌CO (г) + Cl2 (г) имеет K = 2.2 × 10 −10 при 100 ° C. Начиная с начального PCOCl2, равного 1,0 атм, вы определяете следующие значения P CO в трех последовательных интервалах времени: 6,32 × 10 −6 атм, 1,78 × 10 −6 атм и 1,02 × 10 −5 атм. Исходя из этих данных, в каком направлении будет развиваться реакция после каждого измерения? Если в систему будет добавлен газообразный хлор, как это повлияет на Q ?
В следующей таблице приведены экспериментально определенные парциальные давления при трех температурах для реакции Br2 (г) ⇌2Br (г).
Т (К) 1123 1173 1273 PBr2 (атм) 3.000 0,3333 6.755 × 10 −2 П Br (атм) 3,477 × 10 −2 2,159 × 10 −2 2,191 × 10 −2 Это эндотермическая или экзотермическая реакция? Объясните свои рассуждения.
Диссоциация водяного пара протекает по реакции: h3O (г) ⇌12O2 (г) + h3 (г). При 1300 K диссоциация составляет 0,0027%, а при 2155 K диссоциация составляет 1,18%. Вычислите K и K p . Это эндотермическая реакция или экзотермическая реакция? Как соотносятся величины двух равновесий? Может ли увеличение давления улучшить выход газа H 2 при любой температуре? (Подсказка: предположим, что система изначально содержит 1.00 моль H 2 O в емкости 1,00 л.)
Когда 1,33 моль CO 2 и 1,33 моль H 2 смешиваются в емкости 0,750 л и нагреваются до 395 ° C, они реагируют согласно следующему уравнению: CO2 (г) + h3 (г) ⇌CO (г) + h3O (г). Если K = 0,802, каковы равновесные концентрации каждого компонента равновесной смеси? Что произойдет с K , если H 2 O будет удален в ходе реакции?
Равновесная реакция h3 (г) + Br2 (г) ⇌2HBr (г) имеет K p = 2.2 × 10 9 при 298 К. Если вы начнете с 2,0 моль Br 2 и 2,0 моль H 2 в контейнере на 5,0 л, каково парциальное давление HBr в состоянии равновесия? Каково парциальное давление H 2 в состоянии равновесия? Если удалить из системы H 2 , как повлияет на парциальное давление Br 2 ?
Оксид железа (II) реагирует с монооксидом углерода в соответствии со следующим уравнением: FeO (т) + CO (г) ⇌Fe (т) + CO2 (г).При 800 ° C K = 0,34; при 1000 ° C, K = 0,40.
- В контейнер емкостью 20,0 л загружается 800,0 г CO 2 , 1436 г FeO и 1120 г железа. Каковы равновесные концентрации всех компонентов смеси при каждой температуре?
- Каковы парциальные давления газов при каждой температуре?
- Если бы CO был удален, каков был бы эффект на PCO2 при каждой температуре?
Константа равновесия K для реакции C (т) + CO2 (г) ⇌2CO (г) равна 1.9 при 1000 К и 0,133 при 298 К.
- Если позволить избытку C взаимодействовать с 25,0 г CO 2 в колбе емкостью 3,00 л, сколько граммов CO образуется при каждой температуре?
- Каковы парциальные давления каждого газа при 298 К? при 1000 К?
- Ожидаете ли вы, что K увеличится или уменьшится, если давление будет увеличиваться при постоянной температуре и объеме?
Данные по окислению метана, Ch5 (г) + 2O2 (г) CO2 (г) + 2h3O (г), в закрытом 5.Резервуары емкостью 0 л указаны в следующей таблице. Заполните пропуски и определите недостающие значения Q и K (обозначены?) По мере завершения реакции.
CH 4 О 2 CO 2 H 2 O квартал К начальное (моль) 0.45 0,90 0 0 ? в состоянии равновесия 1.29 добавить 0,50 моль метана 0,95 ? новое равновесие ? удалить воду 0 ? новое равновесие 1.29
ответов
- Kp = PCOCl2PCO · PCl2
Ни одно из изменений не повлияет на K ; (a) Q — удвоение; (b) Q уменьшено вдвое; Q уменьшается.
K не изменится; это не зависит от громкости.
[CO] = [H 2 O] = 0.839 M, [CO 2 ] = [H 2 ] = 0,930 M; не влияет на K
- При 800 ° C [CO] = 0,678 M, [CO 2 ] = 0,231 M; при 1000 ° C, [CO] = 0,645 M, [CO 2 ] = 0,264 M
- При 800 ° C, P CO = 59,7 атм, PCO2 = 20.3 атм; при 1000 ° C, P CO = 67,4 атм, PCO2 = 27,6 атм.
- Удаление CO вызовет смещение реакции вправо, что приведет к снижению PCO2.
CH 4 О 2 CO 2 H 2 O квартал К начальное (моль) 0.45 0,90 0 0 0 1,29 в состоянии равновесия 0.215 0,43 0,235 0,47 К 1,29 добавить 0,50 моль метана 0.715 0,43 0,235 0,47 0,39 1,29 новое равновесие 0.665 0,33 0,285 0,57 К 1,29 удалить воду 0.665 0,33 0,285 0 0 1,29 новое равновесие 0.57 0,14 0,38 0,19 К 1,29
