Рисунок «Строение мышц человека»
Строение мышц человека — схема
Рис. 1. Мышцы человека (вид спереди): 1 — лобное брюшко затылочно-лобной мышцы; 2 — круговая мышца рта; 3 — подбородочная; 4 — грудино-подъязычная; 5 — трапециевидная; 6 — трехглавая плеча; 7 — прямая живота; 8 — наружная косая живота; 9 — лучевой сгибатель кисти; 10 — натягивающая широкую фасцию бедра; 11 — подвздошно-поясничная; 12— гребешковая, 13 — длинная приводящая; 14 — портняжная; 15 —прямая бедра; 16 — нежная; 17 — внутренняя широкая; 18 — отводящая большой палец; 19 — сухожилия длинной мышцы, разгибающей пальцы; 20 — длинная мышца, разгибающая пальцы; 21 — камбаловидная; 22 — передняя большеберцовая; 23 — икроножная; 24 — наружная широкая; 25 — короткая мышца, разгибающая большой палец; 26 — длинная мышца, отводящая большой палец; 27 — локтевой разгибатель кисти; 28 — короткий лучевой разгибатель кисти; 29 — разгибатель пальцев; 30 — длинный лучевой разгибатель кисти; 31 — плечелучевая; 32 — трехглавая плеча; 33 — передняя зубчатая; 34 — двуглавая плеча; 35 — большая грудная; 36 — дельтовидная; 37 — передняя лестничная; 38 — средняя лестничная; 39 — грудино-ключично-сосковая; 40 — опускающая угол рта; 41 — жевательная; 42 — большая скуловая; 43 — височная.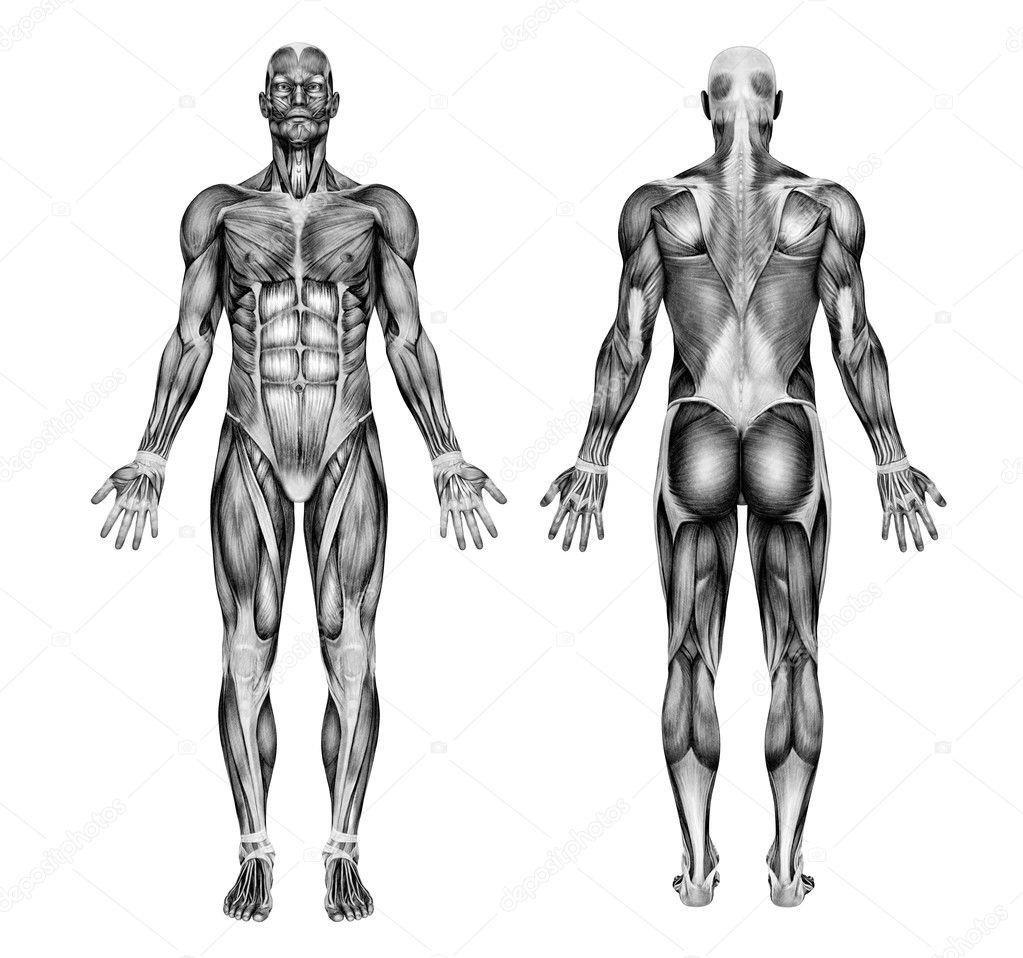
Рис. 2. Мышцы человека (вид сзади): 1 — затылочное брюшко затылочно-лобной мышцы; 2— трапециевидная; 3 — дельтовидная; 4 — трехглавая плеча; 5 — двуглавая плеча: 6 — круглый пронатор; 7 и 23 — плечелучевая; 8 — лучевой сгибатель кисти; 9 — длинная ладонная; 10 — локтевой сгибатель кисти; 11 — поверхностный сгибатель пальцев; 12 и 13 — полуперепончатая; 13 — полусухожильная; 14 — нежная; 15 — двуглавая бедра; 17 — икроножная; 18 — камбаловидная; 19 — большая ягодичная; 20 — короткая мышца, отводящая большой палец; 21 — средняя ягодичная; 22 — наружная косая живота; 24 —широчайшая спины; 25 — передняя зубчатая; 26 — большая круглая; 27 — малая круглая; 28 — полостная; 29 — грудино-ключично-сосковая; 30 — ременная головы; 31 — жевательная; 32 — полуостистая головы; 33 — височная.
схема. Фото с описанием мышц
Спортсмену и просто взрослому человеку занимающемуся фитнесом все-таки желательно знать о строении мышц и какие функции они выполняют. Для этого приведена схема строения мышц человека ниже. А также фото с описанием крупных мышц человека.
А также фото с описанием крупных мышц человека.
Строение мышц человека — схема
Рис. 1. Мышцы человека (вид спереди): 1 — лобное брюшко затылочно-лобной мышцы; 2 — круговая мышца рта; 3 — подбородочная; 4 — грудино-подъязычная; 5 — трапециевидная; 6 — трехглавая плеча; 7 — прямая живота; 8 — наружная косая живота; 9 — лучевой сгибатель кисти; 10 — натягивающая широкую фасцию бедра; 11 — подвздошно-поясничная; 12— гребешковая, 13 — длинная приводящая; 14 — портняжная; 15 —прямая бедра; 16 — нежная; 17 — внутренняя широкая; 18 — отводящая большой палец; 19 — сухожилия длинной мышцы, разгибающей пальцы; 20 — длинная мышца, разгибающая пальцы; 21 — камбаловидная; 22 — передняя большеберцовая; 23 — икроножная; 24 — наружная широкая; 25 — короткая мышца, разгибающая большой палец; 26 — длинная мышца, отводящая большой палец; 27 — локтевой разгибатель кисти; 28 — короткий лучевой разгибатель кисти; 29 — разгибатель пальцев; 30 — длинный лучевой разгибатель кисти; 31 — плечелучевая; 32 — трехглавая плеча; 33 — передняя зубчатая; 34 — двуглавая плеча; 35 — большая грудная; 36 — дельтовидная; 37 — передняя лестничная; 38 — средняя лестничная; 39 — грудино-ключично-сосковая; 40 — опускающая угол рта; 41 — жевательная; 42 — большая скуловая; 43 — височная.
Рис. 2. Мышцы человека (вид сзади): 1 — затылочное брюшко затылочно-лобной мышцы; 2— трапециевидная; 3 — дельтовидная; 4 — трехглавая плеча; 5 — двуглавая плеча: 6 — круглый пронатор; 7 и 23 — плечелучевая; 8 — лучевой сгибатель кисти; 9 — длинная ладонная; 10 — локтевой сгибатель кисти; 11 — поверхностный сгибатель пальцев; 12 и 13 — полуперепончатая; 13 — полусухожильная; 14 — нежная; 15 — двуглавая бедра; 17 — икроножная; 18 — камбаловидная; 19 — большая ягодичная; 20 — короткая мышца, отводящая большой палец; 21 — средняя ягодичная; 22 — наружная косая живота; 24 —широчайшая спины; 25 — передняя зубчатая; 26 — большая круглая; 27 — малая круглая; 28 — полостная; 29 — грудино-ключично-сосковая; 30 — ременная головы; 31 — жевательная; 32 — полуостистая головы; 33 — височная.
Мышцы человека: фото с описанием
Давайте кратко разберём крупные мышцы, а чтобы было понятнее строение мышечной системы человека приведены названия мышц человека в картинках.
Верхний плечевой пояс
Двуглавая мышца плеча (бицепс) — сгибание плеча (в локтевом суставе)
Трёхглавая мышца плеча (трицепс) — учавствует в разгибании плеча
Дельтовидная мышца плеча — выполняет функцию сгибания и разгибания плеча, а также отведение плеча
Большая грудная мышца — выполняет функцию приведения плеча и вращения его внутрь
Мышцы нижних конечностей
Двуглавая мышца бедра — выполняет следующие функции: вращение голени наружу, разгибание бедра, сгибание голени в коленном суставе. При укреплённой голени разгибают туловище совместно с большими ягодичными мышцами.
Большая ягодичная мышца — разгибает и поворачивает бедро кнаруже. Выпрямляет и фиксирует туловище.
Четырехглавая мышца бедра — разгибание в коленном суставе.
\
Икроножные мышцы — работа стопы и стабилизация тела при ходьбе, беге, прыжках.
Мышци живота
Наружняя косая мышца живота, поперечная мышца живота, внутрення косая мышца живота и прямая мышца живота — образуя плотный мышечный каркас выполняют функцию пддержания внуренних органов. Сгибание позвоночного столба и наклон туловища вправо-влево, скручивания.
Мышцы спины
Широчайшая мышца спины — функции: приведение плеча к туловищу, пронация. Также расширяет грудную клетку (работает как вспомогательная дыхательным мышцам).
Трапецевидная мышца — функции: поднятие или опускание лопатки, И приближение лопатки к позвоночному столбу.
%d1%80%d0%b8%d1%81%d1%83%d0%bd%d0%be%d0%ba%20%d1%87%d0%b5%d0%bb%d0%be%d0%b2%d0%b5%d0%ba%d0%b0 — с русского на все языки
Все языкиАнглийскийРусскийКитайскийНемецкийФранцузскийИспанскийИтальянскийЛатинскийФинскийГреческийИвритАрабскийСуахилиНорвежскийПортугальскийВенгерскийТурецкийИндонезийскийШведскийПольскийЭстонскийЛатышскийДатскийНидерландскийАрмянскийУкраинскийЯпонскийСанскритТайскийИрландскийТатарскийСловацкийСловенскийТувинскийУрдуИдишМакедонскийКаталанскийБашкирскийЧешскийГрузинскийКорейскийХорватскийРумынский, МолдавскийЯкутскийКиргизскийТибетскийБелорусскийБолгарскийИсландскийАлбанскийНауатльКомиВаллийскийКазахскийУзбекскийСербскийВьетнамскийАзербайджанскийБаскскийХиндиМаориКечуаАканАймараГаитянскийМонгольскийПалиМайяЛитовскийШорскийКрымскотатарскийЭсперантоИнгушскийСеверносаамскийВерхнелужицкийЧеченскийГэльскийШумерскийОсетинскийЧеркесскийАдыгейскийПерсидскийАйнский языкКхмерскийДревнерусский языкЦерковнославянский (Старославянский)МикенскийКвеньяЮпийскийАфрикаансПапьяментоПенджабскийТагальскийМокшанскийКриВарайскийКурдскийЭльзасскийФарерскийАбхазскийАрагонскийАрумынскийАстурийскийЭрзянскийКомиМарийскийЧувашскийСефардскийУдмурдскийВепсскийАлтайскийДолганскийКарачаевскийКумыкскийНогайскийОсманскийТофаларскийТуркменскийУйгурскийУрумскийБурятскийОрокскийЭвенкийскийМаньчжурскийГуараниТаджикскийИнупиакМалайскийТвиЛингалаБагобоЙорубаСилезскийЛюксембургскийЧерокиШайенскогоКлингонский
Все языкиАнглийскийНемецкийНорвежскийКитайскийИвритФранцузскийУкраинскийИтальянскийПортугальскийВенгерскийТурецкийПольскийДатскийЛатинскийИспанскийСловенскийГреческийЛатышскийФинскийПерсидскийНидерландскийШведскийЯпонскийЭстонскийТаджикскийАрабскийКазахскийТатарскийЧеченскийКарачаевскийСловацкийБелорусскийЧешскийАрмянскийАзербайджанскийУзбекскийШорскийРусскийЭсперантоКрымскотатарскийСуахилиЛитовскийТайскийОсетинскийАдыгейскийЯкутскийАйнский языкЦерковнославянский (Старославянский)ИсландскийИндонезийскийАварскийМонгольскийИдишИнгушскийЭрзянскийКорейскийИжорскийМарийскийМокшанскийУдмурдскийВодскийВепсскийАлтайскийЧувашскийКумыкскийТуркменскийУйгурскийУрумскийЭвенкийскийБашкирскийБаскский
Опорно-двигательная система.
 Скелет человека — урок. Окружающий мир, 3 класс.
Скелет человека — урок. Окружающий мир, 3 класс.Внутри нашего тела находится скелет. К нему прикрепляются мышцы.
Скелет и мышцы составляют опорно-двигательную систему.
Эта система:
- служит опорой телу;
- защищает внутренние органы;
- позволяет нашему организму двигаться.
Скелет
В скелете человека более \(200\) костей. У всех костей есть свои названия. Кости твёрдые и прочные. Каждая имеет определённые размеры и форму.
Скелет:
- является опорой тела;
- поддерживает форму тела;
- защищает все внутренние органы от повреждений.
Кости в скелете соединены так, что при движении могут изменять своё положение.
Заставляют кости двигаться прикреплённые к ним мышцы.
В скелете человека выделяют череп, позвоночник, грудную клетку, таз, верхние конечности (руки) и нижние конечности (ноги).
Рис. \(1\). Скелет человека
Череп защищает головной мозг от повреждений. Он образован твёрдыми и прочными костями.
Он образован твёрдыми и прочными костями.
Позвоночник является главной опорой нашего тела. Без позвоночника человек не смог бы стоять и ходить. Позвоночник состоит из \(33\) позвонков. Позвонки имеют отверстия, которые образуют позвоночный канал. В нём расположен спинной мозг.
Грудная клетка образована рёбрами и надёжно защищает сердце и лёгкие.
К грудной клетке при помощи ключиц и лопаток прикреплены кости верхних конечностей — рук. Кости рук соединены подвижно. Поэтому мы можем их поднимать, опускать, сгибать в локтях и выполнять много других движений.
К нижней части позвоночника присоединены кости таза. Таз поддерживает и защищает внутренние органы. С тазом подвижно соединены кости нижних конечностей — ног.
Источники:
Источники:
Рис.1. Скелет человека https://cdn.pixabay.com/photo/2020/08/19/11/54/human-skeleton-5500722_960_720.png
FGF-2-зависимая передача сигналов, активированная в скелетных мышцах пожилого человека, способствует внутримышечному адипогенезу
Значимость
Уникальной особенностью мышц во время старения, ожирения и диабета 2 типа является появление жировой ткани между волокнами скелетных мышц и внутримышечной жировой тканью. (Я В). IMAT обычно ассоциируется с инсулинорезистентностью, снижением мышечной силы и, у пожилых людей, нарушением подвижности. Однако молекулярные сигналы, вызывающие патологическое образование IMAT, в настоящее время неизвестны.Эта работа раскрывает консервативную FGF-2-опосредованную сигнальную ось, которая активирует экспрессию microRNA-29a, вызывая снижение адипогенного ингибитора SPARC и повышенное образование жира в старых скелетных мышцах. Мы показываем, что FGF-2-зависимая передача сигналов модулирует судьбу фибро / адипогенных предшественников и их склонность к дифференцировке во внутримышечные адипоциты, что открывает терапевтические возможности для предотвращения образования IMAT в скелетных мышцах человека.
Abstract
Старые скелетные мышцы сильно страдают от инфильтрации жировых мышц, поэтому срочно необходимы стратегии для уменьшения появления внутримышечных адипоцитов.Здесь мы показываем, что фактор роста фибробластов-2 (FGF-2) не только стимулирует рост мышц, но также способствует внутримышечному адипогенезу. Используя многочисленные скрининговые анализы перед и после передачи сигналов микроРНК (miR) -29a, мы локализовали секретируемый белок и адипогенный ингибитор SPARC в пути передачи сигнала FGF-2, который сохраняется между клетками скелетных мышц от мышей и людей и активируется в скелетных мышцах. старых мышей и людей. FGF-2 индуцирует ось miR-29a / SPARC посредством активации транскрипции FRA-1, который связывает и активирует эволюционно консервативный элемент сайта AP-1 проксимальнее промотора miR-29a.Генетические делеции в мышечных клетках и опосредованная аденоассоциированным вирусом избыточная экспрессия FGF-2 или SPARC в скелетных мышцах мышей показали, что эта ось регулирует дифференцировку фибро / адипогенных предшественников in vitro и образование внутримышечной жировой ткани (IMAT) in vivo.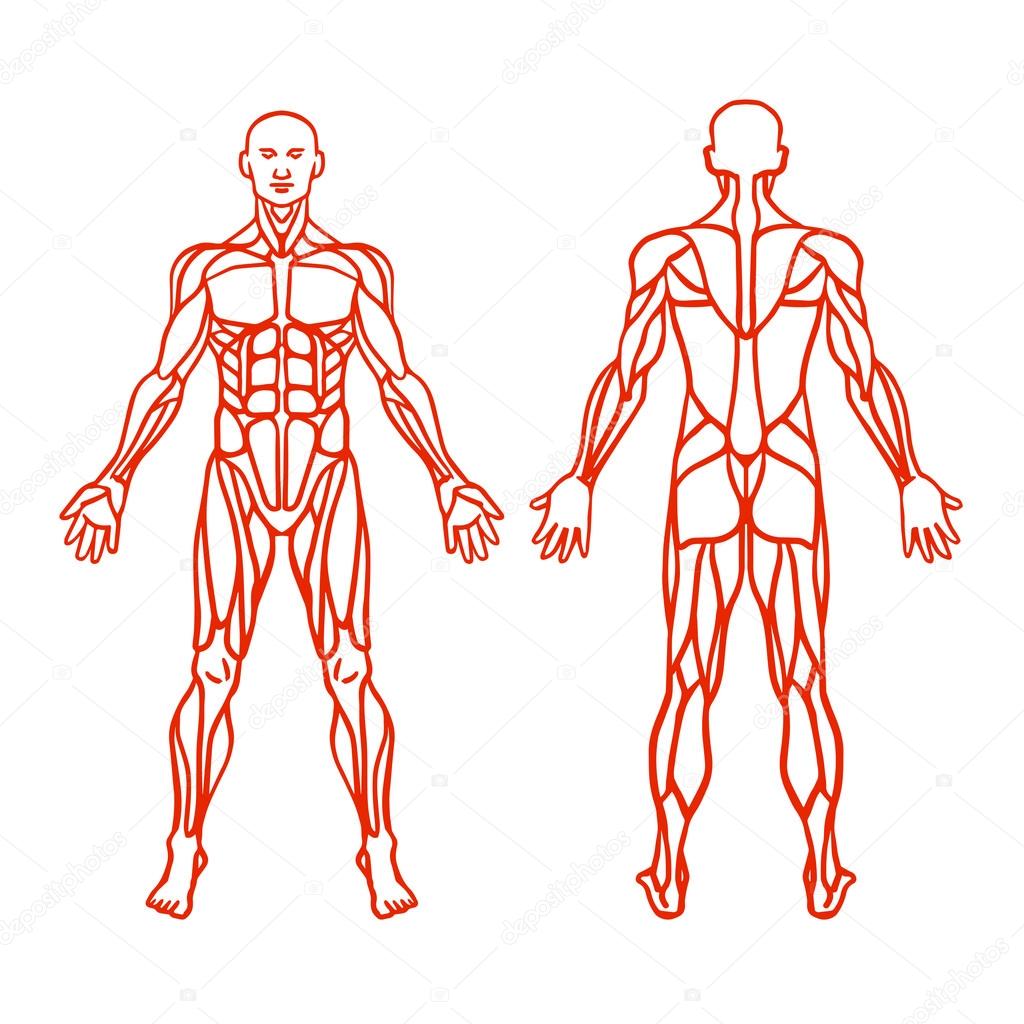 Скелетные мышцы от людей-доноров в возрасте> 75 лет по сравнению с <55 лет показали активацию FGF-2-зависимой передачи сигналов и увеличение IMAT. Таким образом, наши данные подчеркивают несопоставимую роль FGF-2 в скелетных мышцах взрослых и раскрывают путь борьбы с накоплением жира в скелетных мышцах пожилого человека.
Скелетные мышцы от людей-доноров в возрасте> 75 лет по сравнению с <55 лет показали активацию FGF-2-зависимой передачи сигналов и увеличение IMAT. Таким образом, наши данные подчеркивают несопоставимую роль FGF-2 в скелетных мышцах взрослых и раскрывают путь борьбы с накоплением жира в скелетных мышцах пожилого человека.
Скелетные мышцы — фундаментальный орган для здоровья человеческого тела (1). Он составляет 40% массы всего тела и обеспечивает движение, осанку и стабильность. Кроме того, скелетные мышцы участвуют в выработке тепла и метаболизме всего тела. Снижение поглощения глюкозы мышечной тканью способствует липогенезу de novo в печени (2), в то время как способность скелетных мышц окислять жирные кислоты определяет прибавку в весе и ожирение (3). Активация скелетных мышц во время упражнений может положительно влиять на симпатическую активность и воспаление (4), а также на секрецию миокинов в кровоток (5).Поэтому стратегии по поддержанию мышечной массы и функции имеют решающее значение для предотвращения заболеваемости среди населения.
Старение, ожирение и неиспользование мышц представляют собой серьезную угрозу здоровью мышц в обществе. Начиная с 40 лет мышечная масса снижается на 8% за десятилетие (6). Хотя этот процесс варьируется, у пожилых людей потеря мышечной массы может снизиться более чем на 2 SD ниже среднего значения для молодых здоровых взрослых. Это резкое снижение мышечной массы определяется как саркопения и является одним из основных факторов нежелательных явлений у пожилых людей, таких как падения, инвалидность и смерть, которые обозначаются термином слабость (7).Как только мышечная масса уменьшается, следует снижение скорости основного обмена. Следствием этого является рост распространенности ожирения, инсулинорезистентности скелетных мышц и сахарного диабета 2 типа в группе людей в возрасте 65 лет и старше (8, 9).
Молекулярные механизмы, которые способствуют снижению массы скелетных мышц при старении и диабете 2 типа, сложны и все еще не полностью изучены. Однако уникальной особенностью мышц при старении, ожирении и диабете 2 типа является появление жировой ткани между волокнами скелетных мышц, внутримышечной жировой тканью (IMAT) (10–12). У субъектов с избыточным весом (индекс массы тела от 28 до 30 кг / м 2 2 ) количество IMAT может быть значительным и, по оценкам, составляет 5% (женщины) или 10% (мужчины) жировой ткани всего тела ( 11). IMAT обычно ассоциируется с системной инсулинорезистентностью (11, 13), снижением мышечной силы (14), а у пожилых людей — с нарушением подвижности (15–17). Большой объем работ за последние годы был посвящен происхождению IMAT. Скелетная мышца содержит предшественники преадипоцитов, называемые фибро / адипогенными предшественниками (FAP), которые обычно не образуют адипоциты, но пролиферируют во время мышечного повреждения, чтобы поддерживать обязательство миогенных клеток-предшественников (MP) во время восстановления мышц (18).Однако в условиях, описанных выше, вместо того, чтобы подвергаться апоптозу, FAPs дифференцируются в адипоциты и вызывают IMAT (18–20). Молекулярные сигналы, запускающие этот патогенез, неизвестны и требуют дальнейшего изучения.
У субъектов с избыточным весом (индекс массы тела от 28 до 30 кг / м 2 2 ) количество IMAT может быть значительным и, по оценкам, составляет 5% (женщины) или 10% (мужчины) жировой ткани всего тела ( 11). IMAT обычно ассоциируется с системной инсулинорезистентностью (11, 13), снижением мышечной силы (14), а у пожилых людей — с нарушением подвижности (15–17). Большой объем работ за последние годы был посвящен происхождению IMAT. Скелетная мышца содержит предшественники преадипоцитов, называемые фибро / адипогенными предшественниками (FAP), которые обычно не образуют адипоциты, но пролиферируют во время мышечного повреждения, чтобы поддерживать обязательство миогенных клеток-предшественников (MP) во время восстановления мышц (18).Однако в условиях, описанных выше, вместо того, чтобы подвергаться апоптозу, FAPs дифференцируются в адипоциты и вызывают IMAT (18–20). Молекулярные сигналы, запускающие этот патогенез, неизвестны и требуют дальнейшего изучения.
Здесь мы раскрываем непостоянную роль FGF-2, который участвует не только в росте миогенных предшественников и волокон, но также поддерживает дифференцировку FAP. Следуя восходящим и нисходящим сигнальным событиям главного регулятора миогенеза, микроРНК (miR) -29a (21), мы идентифицировали сложный путь передачи сигналов FGF-2 в мышечных клетках, который усиливает дифференцировку FAP in vitro и способствует образованию IMAT in vivo. во время регенерации мышц за счет подавления миокина SPARC.Кроме того, путь FGF-2 / miR-29a / SPARC усиливается в старых скелетных мышцах мышей и людей. Наши результаты раскрывают неожиданную сторону действия FGF-2, которая может предоставить новые стратегии предотвращения образования IMAT в старых скелетных мышцах.
Следуя восходящим и нисходящим сигнальным событиям главного регулятора миогенеза, микроРНК (miR) -29a (21), мы идентифицировали сложный путь передачи сигналов FGF-2 в мышечных клетках, который усиливает дифференцировку FAP in vitro и способствует образованию IMAT in vivo. во время регенерации мышц за счет подавления миокина SPARC.Кроме того, путь FGF-2 / miR-29a / SPARC усиливается в старых скелетных мышцах мышей и людей. Наши результаты раскрывают неожиданную сторону действия FGF-2, которая может предоставить новые стратегии предотвращения образования IMAT в старых скелетных мышцах.
Результаты
SPARC является консервативной мишенью miR-29a в скелетных мышцах.
Ранее мы показали, что miR-29a является главным регулятором дифференцировки мышечных клеток in vitro (21) и регенерации мышц in vivo (22). Интересно, что ингибирование miR-29a в линии мышечных клеток C2C12 влияет на адипогенную дифференцировку клеток 3T3 в системе сокультивирования (рис.1 А ). Чтобы понять, как ингибирование miR-29a в мышечных клетках снижает адипогенную дифференцировку, мы приступили к идентификации секретируемых мишеней miR-29a, которые участвуют в перекрестном взаимодействии между скелетными мышцами и адипоцитами. Мы использовали наборы данных как транскриптомики, так и протеомики, в которых miR-29a подавлялась в первичных миобластах человека и мышечных трубках C2C12, соответственно. Ранее мы опубликовали набор данных глубокого секвенирования РНК мышечных трубок человека (21), который мы теперь повторно проанализировали специально для мишеней miR-29a.Для набора данных протеомики жидкостная хроматография-масс-спектрометрия (LC-MS / MS) была проведена на супернатантах миотрубок C2C12. Успешное подавление miR-29a было подтверждено с помощью сдвига вправо графиков кумулятивного распределения предсказанных генов-мишеней miR-29a по сравнению с нецелевыми ( SI Приложение , рис. S1 A и B ), а также с помощью с использованием анализа графика обогащения ( SI Приложение , рис. S1, C и D ) в обоих экспериментальных условиях.Подавление miR-29a во время дифференцировки миобластов человека значительно активировало 3 827 генов и подавляло 3 497 генов со значением P <0,05, в то время как подавление miR-29a в мышечных трубках значительно увеличивало изобилие 79 белков и уменьшило 54 белка ( P <0,05) в супернатанте. Чтобы обогатить секретируемые белки потенциальными функциями перекрестных помех, данные ЖХ-МС / МС были отфильтрованы для прямых мишеней miR-29a-3p с использованием TargetScan v7.2, в то время как белки, обеспечивающие структурную поддержку, были исключены (10 белков, помеченных как компонент внеклеточной матрицы; термин генной онтологии 0044420). Секретируемый миокин (23) и мишень miR-29a (24). Секретируемый кислый и богатый цистеином белок (SPARC) был наиболее значимо активированным геном и белком как в наборах транскриптомных, так и в протеомных данных (Рис. 1 B, и ). С ). SI Приложение , таблица S1 предоставляет полный список значительно измененных белков и их потенциальную роль в адипогенезе.Мы использовали три стратегии, чтобы предоставить доказательства того, что SPARC является прямой мишенью miR29a в скелетных мышцах. Во-первых, in vitro, повышенные или подавленные уровни SPARC в ответ на лечение антагомирами или миметиками miR-29a были обнаружены на уровне информационной РНК (мРНК) и в виде секретируемого белка в культурах миотрубок C2C12 (рис. 1 D, и G). ), а также на уровне мРНК и секретируемого белка в первичных мышиных и первичных мышечных трубках человека (Рис.1 E и F и SI Приложение , Рис.S1 E и F ). Во-вторых, in vivo мы использовали две модели нокаута miR-29a в скелетных мышцах взрослых мышей: ACTA1-Cre-miR-29a fl / fl , что позволило достичь 50% истощения miRNA (рис. 1 H ). ), и Pax7-Cre-miR-29a fl / fl , в котором miR-29a истощена на 70% (рис. 1 J ). Только истощение miR-29a на 70% привело к увеличению экспрессии Sparc в скелетных мышцах взрослых, что указывает на порог гена-мишени miRNA, требующий нокдауна miR-29a> 50% (рис.1 I и K ). В-третьих, чтобы доказать, что SPARC действительно является прямой мишенью для miR-29a, мы удалили два предсказанных и консервативных сайта связывания для miR-29a в 3′-нетранслируемой области (UTR) SPARC. Делеция этих сайтов ослабляет miR-29a-зависимую репрессию в анализах репортерных генов ( SI Приложение , Fig. S1, G и H ). Вместе наши результаты идентифицируют Sparc как консервативную регулируемую мишень miR-29a в скелетных мышцах как in vitro, так и in vivo.Таким образом, мы предположили, что ингибирование miR-29a в мышечных клетках приводит к усилению регуляции и последующей секреции SPARC, что приводит к подавлению адипогенной дифференцировки в системе сокультивирования.
Рис. 1.SPARC регулируется miR-29a в скелетных мышцах как in vitro, так и in vivo. ( A ) Совместное культивирование миотрубок C2C12, трансфицированных антагомирным отрицательным контролем (NC) или клетками антагомира-29a и 3T3-L1. Отсутствие совместного контроля показывает клетки 3T3-L1, культивируемые без мышечных трубок C2C12.Репрезентативные изображения показывают окрашивание липидных капель (Bodipy; зеленый) и ядер (Hoechst; синий) клеток 3T3-L1 на 8-й день после индукции адипогенеза. Площадь липидов нормирована по ядрам ( n = 3). (Масштабная шкала, 5 мм, вверху ; 100 мкм, внизу. ) ( B и C ) Графики вулканов (значимость по сравнению с логарифмом 2 FC) значительно измененных ( B ) генов ( n = 3; FC> | 2 | и P <0,05) или ( C ) белков ( n = 4; FC> | 1 | и P <0.05) после ингибирования miR-29a; n.s. = не имеет значения. ( D — F ) Экспрессия Sparc в миотрубках ( D ) C2C12 ( n = 6), ( E ) первичных мышечных трубках ( n = 7) и ( F ) человека первичные миотрубки ( n = 7) после ингибирования или сверхэкспрессии miR-29a. Значения qPCR были нормализованы к 18S рибосомной РНК (рРНК) и нанесены на график относительно антагомира или миметика отрицательного контроля. ( G ) Уровни секретируемого SPARC в кондиционированной среде мышечных трубок C2C12 после ингибирования или сверхэкспрессии miR-29a по оценке с помощью иммуноферментного анализа ( n = 6).Уровни SPARC нанесены на график относительно антагомира или миметика отрицательного контроля. ( H и J ) miR-29a и ( I и K ) Экспрессия Sparc в ACTA1-Cre miR-29a fl / fl по сравнению с miR-29a fl / fl ( n = 5) или Pax7-Cre miR-29a fl / fl по сравнению с мышами miR-29a fl / fl ( n = 7). Значения qPCR были нормализованы до 18S рРНК (Sparc) или snoRNA234 (miR-29a). Данные в A, и D — K нанесены на график как среднее ± стандартная ошибка среднего.Достоверность оценивали с помощью ( A ) одностороннего дисперсионного анализа с тестом множественных сравнений Тьюки, ( B и C ) статистики дифференциальной экспрессии (значение Бенджамини-Хохберга с поправкой на P, ) и ( D — K). ) двусторонний непарный тест Стьюдента t . * P ≤ 0,05 ** P ≤ 0,01; *** P ≤ 0,001.
Ось miR-29a / SPARC регулирует дифференцировку предипоцитов скелетных мышц in vitro.
Чтобы оценить функциональную роль SPARC ниже miR-29a в качестве потенциального модулятора судьбы клеток FAP, мы сгенерировали четыре линии клеток C2C12 с геномными делециями элементов узнавания miR-29a (MRE) в 3′-UTR Sparc с использованием CRISPR. / Cas9 (Sparc ΔMRE , SI Приложение , рис.S2 A ). Повышение регуляции Sparc на уровне белка, когда его содержание в супернатанте мутантных клеток по сравнению с клетками дикого типа было увеличено примерно в два раза, отражалось почти двукратным повышением регуляции на уровне мРНК как в миобластах, так и в мышечных трубках. (Рис.2 A и B и SI Приложение , Рис. S2 B ). Поразительно, что ингибирование miR-29a в мутантных клетках не вызывает дальнейшего увеличения мРНК SPARC, определенно доказывая, что регуляция SPARC после ингибирования miR-29a вызывается непосредственно связыванием miR-29a.Способность миобластов C2C12 к пролиферации после ингибирования miR-29a была снижена (рис. 2 C ), что является признаком действия miR-29a в мышечных клетках (22). Этот фенотип также присутствовал в клетках C2C12 Sparc ΔMRE , указывая на то, что Sparc не участвует во внутренних событиях передачи сигналов в мышечных клетках ниже miR-29a (Fig. 2 C ). Чтобы оценить, влияет ли SPARC на способность к дифференцировке предшественников адипоцитов, мы совместно культивировали клеточные линии Sparc wt или Sparc ΔMRE с клетками 3T3 или FAP, выделенными из скелетных мышц мыши (рис.2 D — I ). Клетки Sparc ΔMRE сильно ингибировали дифференцировку как преадипоцитов 3T3, так и FAP и снижали экспрессию адипогенных и липогенных генов в обоих типах клеток по сравнению с клетками Sparc wt . Ингибирование дифференцировки FAP может быть прямым эффектом SPARC, по крайней мере частично, поскольку инкубация FAP с рекомбинантным SPARC также способна снизить дифференцировку FAP ( SI Приложение , рис. S2 C – E ). .Важно отметить, что повышение уровня SPARC не повлияло на фиброгенные, остеогенные или гладкомышечные программы в FAP ( SI Приложение , рис. S2 F – H ). Снижение уровней Sparc в клетках C2C12 во время экспериментов по совместному культивированию с использованием приготовленной эндорибонуклеазой малой интерферирующей РНК (esiRNA) увеличивало дифференцировку адипоцитов на исходном уровне и в присутствии антагомира-29a ( SI Приложение , рис. S2 I ). Более того, снижение уровней Sparc предотвращало ингибирующее действие антагомира-29a на дифференцировку адипоцитов.Важно отметить, что влияние антагомира-29a на дифференцировку клеток 3T3 и esiRNA против Sparc на дифференцировку FAP не ограничивается клетками C2C12, но также может наблюдаться в первичных мышечных клетках мышей и людей ( SI Приложение , рис. S2 J– S ). Вместе эти результаты показывают, что ось miR-29a / SPARC является регулятором дифференцировки адипоцитов, который обеспечивает перекрестные помехи между мышечными клетками и преадипоцитами, находящимися в скелетных мышцах взрослых.
Рис. 2.miR-29a способствует адипогенезу посредством подавления SPARC in vitro.( A ) Экспрессия Sparc в миобластах дикого типа (wt) или C2C12 с удаленными элементами распознавания miR-29a (C2C12 Sparc ΔMRE ) после ингибирования miR-29a ( n = 4). Значения qPCR были нормализованы к 18S рибосомной РНК (рРНК). ( B ) Уровни секретируемого SPARC в кондиционированной среде из миобластов wt или C2C12 с удаленными элементами распознавания miR-29a (C2C12 Sparc ΔMRE ) по оценке с помощью иммуноферментного анализа ( n = 4). ( C ) Клеточная пролиферация в клетках wt или C2C12 с удаленными элементами распознавания miR-29a (C2C12 Sparc ΔMRE ) после ингибирования miR-29a ( n = 4).( D и E ) Совместное культивирование миотрубок wt или C2C12 с удаленными элементами распознавания miR-29a (C2C12 Sparc ΔMRE ) и ( D ) 3T3-L1 ( n = 4) или ( E ) ) ФАПы ( n = 4). Отсутствие контроля сокультуры показывает клетки 3T3-L1 или FAP, культивируемые без мышечных трубок C2C12. Репрезентативные изображения показывают окрашивание липидных капель (Bodipy; зеленый) и ядер (Hoechst; синий) 3T3-L1 или FAP на 8-й день после индукции адипогенеза. Площадь липидов нормирована по ядрам.(Шкала, 5 мм, верх ; 100 мкм, низ .) ( F — I ) Экспрессия адипогенных и липогенных генов ( F и G ) клеток 3T3-L1 или ( H и I ) FAP, совместно культивированные с миотрубками C2C12 Sparc wt или C2C12 Sparc ΔMRE на 8 день после индукции адипогенеза ( n = 4). Отсутствие контроля сокультуры показывает клетки 3T3-L1 или FAP, культивируемые без мышечных трубок C2C12. Значения qPCR были нормализованы до 18S рРНК.Все данные представлены как среднее ± стандартная ошибка среднего. Значимость оценивали с помощью ( A и C — I ) одностороннего дисперсионного анализа с тестом множественных сравнений Тьюки и ( B ) двустороннего непарного теста Стьюдента t . * P ≤ 0,05; ** P ≤ 0,01; *** P ≤ 0,001.
Ось передачи сигналов FGF-2 / MEK1 / 2 / MAPK регулирует Sparc через miR-29a.
Поскольку miR-29a регулирует судьбу клеток FAP, мы решили расшифровать регуляторный путь выше этой основной miRNA.Среди нескольких факторов роста и гормонально значимых сигналов для скелетных мышц только FGF-2 был способен индуцировать miR-29a в мышечных трубках C2C12 (рис. 3 A ), в соответствии с нашими предыдущими опубликованными наблюдениями о том, что miR-29a / b1 является наивысший регулируемый кластер миРНК с помощью FGF-2 в первичных миобластах человека (22). Всего через 24 часа после лечения FGF-2 индуцировал дозозависимую повышающую регуляцию miR-29a ( SI Приложение , рис. S3, A и B ) и реципрокное подавление транскрипта SPARC (рис. .3 В ). Поразительно, что опосредованное FGF-2 ингибирование Sparc было отменено в клеточных линиях C2C12 Sparc ΔMRE , что указывает на то, что FGF-2, miR-29a и SPARC принадлежат к одному и тому же пути передачи сигналов (Fig. 3 C ). Чтобы идентифицировать сигнальные события ниже FGF-2, которые опосредуют экспрессию miR-29a, мы клонировали 1867 пар оснований (п.н.) опубликованного промотора miR-29a (25) в репортерный вектор люциферазы. Активация промотора с помощью FGF-2 была локализована во фрагменте длиной 590 п.н. (рис. 3 D и SI, приложение , рис.S3 C ), который был использован в последующих экспериментах с химическими ингибиторами многочисленных внутриклеточных путей ниже FGF-2 (26). В целом мы подавили рецептор FGF-2 (PD173074), передачу сигналов RAS-MAPK (PD184352, нацеливание на MEK1 / 2; NSC23766, нацеливание на Rac GTPase), передачу сигналов PI3K-AKT (LY294002, нацеливание на PI3Kα / δ / β), PLC-γ. передача сигналов (U73122) и передача сигналов STAT (Нифуроксазид) в присутствии FGF-2. Примечательно, что подавление активности промотора miR-29a, активируемой FGF-2, в основном зависело от ингибирования киназы MAPK / ERK 1/2 (MEK1 / 2) (рис.3 E ), что имитировалось сверхэкспрессией доминантной активной формы MEK2 (фиг. 3 F ). В то время как ингибитор PD значительно снижал активность промотора также в отсутствие FGF-2, U73122 не имел никакого эффекта ( SI Приложение , фиг. S3 D ). В первичных мышечных трубках обработка FGF-2 увеличивала фосфорилирование p44 / 42 MAPK, нижестоящей мишени MEK1 / 2 (Fig. 3 G ). Кроме того, как в миобластах, так и в мышечных трубках как мышей, так и людей, ингибирование MEK1 / 2 также предотвращало опосредованную FGF-2 индукцию miR-29a (рис.3 H — J и SI Приложение , Рис. S3 E и F ) и повышенная экспрессия miR-29a target Sparc (Рис. 3 K — M и SI Приложение , рис. S3 G и H ). Интересно, что ингибирование MEK1 / 2 также влияет на уровни miR-29a и экспрессию Sparc в отсутствие FGF-2. Однако величина эффекта была намного меньше по сравнению с регуляцией в присутствии FGF-2 и могла указывать на эндогенную активацию сигнального пути FGF-2 в мышечных клетках.Вместе эти результаты устанавливают, что MEK1 / 2 действует на промотор miR-29a и переводит Sparc в путь, включающий передачу сигналов FGF-2 через MEK1 / 2, p44 / 42 MAPK и miR-29a.
Рис. 3. Передача сигналовFGF-2 снижает Sparc через MEK1 / 2, p42 / 44 MAPK и miR-29a. ( A ) Экспрессия miR-29a в мышечных трубках C2C12 после обработки соответствующими рекомбинантными белками или дексаметазоном ( n = 7). Значения qPCR были нормализованы до snoRNA234. ( B и C ) Экспрессия Sparc в миотрубках ( B ) C2C12 ( n = 4) или в ( C ) миобластах дикого типа и C2C12 с удаленными элементами распознавания miR-29a (C2C12 Sparc ΔMRE ; n = 4) после обработки рекомбинантным FGF-2.Значения qPCR были нормализованы к 18S рибосомной РНК (рРНК). ( D ) активность промотора miR-29a для полноразмерных (-1,493 / + 195) и усеченных (-977 / + 195, -396 / + 195) конструкций промотора после обработки рекомбинантным FGF-2 ( n = 6). ( E ) Активность промотора miR-29a для конструкции усеченного (-396 / + 195) промотора после обработки ингибиторами против FGFR1 (PD173074), MEK1 / 2 (PD184352), Rac GTPase (NSC23766), PI3Kα / δ / β ( LY294002), STAT1 / 3/5 (нифуроксазид), PLC (U73122) и рекомбинантный FGF-2.Звездочки указывают на значительную разницу по сравнению с контролем диметилсульфоксида, обработанным FGF-2 ( n = 8). ( F ) Активность промотора miR-29a для конструкции усеченного (-396 / + 195) промотора после обработки рекомбинантным FGF-2 или сверхэкспрессии MEK2 (MKK2) ( n = 8). Эксперименты с D — F были выполнены на мышечных трубках C2C12 и оценены нормализованными анализами люциферазы. ( G ) Иммуноблоттинг, показывающий фосфорилирование p44 / 42 MAPK в миотрубках C2C12, обработанных рекомбинантным FGF-2 ( n = 6).Плотности полос были количественно определены и нормализованы к общему p44 / 42 MAPK. Экспрессия ( H — J ) miR-29a и ( K — M ) Sparc в миотрубках ( H и K ) C2C12, ( I и L ) первичных миотрубках мыши, и ( J и M ) первичные мышечные трубки человека после обработки рекомбинантным FGF-2 и ингибирования передачи сигналов MEK1 / 2 (PD184352; n = 6). Значения qPCR были нормализованы к snoRNA234 (miR-29a) или 18S рРНК (Sparc).Все данные представлены как среднее ± стандартная ошибка среднего. Значимость оценивалась с помощью ( A , C — F и H — M ) одностороннего дисперсионного анализа с ( A и E ) Даннетта или ( C , D ). , F и H – M ) тест множественных сравнений Тьюки и ( B и G) двухсторонний непарный тест Стьюдента t ( B и G) . n.s. = не имеет значения; * P ≤ 0,05; ** P ≤ 0,01; *** P ≤ 0.001.
Фактор транскрипции FRA-1 активируется с помощью FGF-2 для индукции экспрессии miR-29a.
Чтобы идентифицировать всех участников каскада сигнальной трансдукции, который определяет экспрессию miR-29a и Sparc, мы исследовали идентичность фактора транскрипции (TF), который опосредует влияние FGF-2 / MEK1 / 2 на miR-29a. промоутер. Мы дополнительно сузили область промотора (рис. 4 A ) и идентифицировали фрагмент промотора длиной 97 п.н. (от -374 до -278 п.н. перед сайтом начала транскрипции), который сохранил свою зависимость от ингибирования MEK1 / 2 и стимуляции MEK2 ( Инжир.4 B и C ). Поскольку фрагмент от -374 до -312 не проявлял промоторной активности, мы сосредоточили внимание на 54-нуклеотидной (нт) области промотора, расположенной от -331 до -278 п.н. Биоинформатический анализ выявил 55 потенциальных цис -регуляторных элементов в этой области с 12 сайтами связывания TF, показывающими относительную оценку соответствия> 0,9. Мы выполнили сайт-направленный мутагенез для последовательного устранения связывания ТФ с 54-нуклеотидной областью промотора в пределах 97-нуклеотидного фрагмента и идентифицировали консервативный консенсусный сайт Fos – Jun, который связывается членами активирующего белка-1 (AP-1). семейство ТФ и реагируют на стимуляцию FGF-2 (рис.4 D и E ). Мутация этого сайта успешно предотвращала стимулированное MEK2 повышение активности промотора по сравнению с фрагментом промотора дикого типа (фиг. 4 F ). ДНК-связывающая активность семейства AP-1 модулируется через фосфорилирование и через его гомо- или гетеродимерный состав, который определяется дифференциальной экспрессией членов белка AP-1 Jun, Fos, активирующего TF (ATF) и мышечно-апоневротической фибросаркомы ( MAF) (27). Среди членов семейства Fos / Jun экспрессия гена Fos-родственного антигена 1 (Fosl1, кодирует белок FRA-1) сильно индуцировалась FGF-2 и заметно подавлялась ингибированием MEK1 / 2 (рис.4 G ). Сверхэкспрессия гена Fosl1 в клетках C2C12 и первичных миобластах мыши активировала промотор miR-29a в отсутствие FGF-2 (рис. 4 H — J ), а нокдаун Fosl1 предотвращал стимулирование FGF-2. увеличение активности промотора miR-29a (рис. 4 K ). Опосредованная аденоассоциированным вирусом (AAV) избыточная экспрессия Fosl1 индуцировала экспрессию miR-29a (фиг.4 L и M ), а нокдаун Fosl1 предотвращал индукцию экспрессии miR-29a с помощью FGF-2 (фиг.4 О ). Наконец, в культивируемых миобластах человека обработка FGF-2 значительно увеличивала фосфорилирование FRA-1 ( SI, приложение , фиг. S4). Анализ иммунопреципитации хроматина (ChIP) успешно продемонстрировал, что фосфорилированный FRA-1 занимает промотор miR-29a в миобластах человека. Это соотношение значительно увеличивается в пять раз в присутствии FGF-2 (рис. 4 P ). Вместе наши результаты определяют ось FGF-2 / FRA-1 / miR-29a / SPARC, которая сохраняется в клетках скелетных мышц мышей и людей.
Рис. 4.TF FRA-1 опосредует экспрессию miR-29a ниже FGF-2. ( A ) Активность промотора miR-29a для укороченных промоторных конструкций, как указано, и обработка рекомбинантным FGF-2 ( n = 6). ( B и C ) активность промотора miR-29a для конструкции усеченного промотора (-374 / -278) после обработки рекомбинантным FGF-2 и ингибирования ( B ) ( n = 6) или ( C ) активация ( n = 8) передачи сигналов MEK1 / 2 (MKK2).( D ) Активность промотора miR-29a для укороченных промоторных конструкций дикого типа (wt) или мутантных (M1, M2, M3) промоторных конструкций после обработки рекомбинантным FGF-2 ( n = 6). Соответствующие мутагенезы отменяли связывание указанных факторов транскрипции, расположенных либо на смысловой (+), либо на антисмысловой (-) цепи. Cis -регуляторные элементы приведены в отношении сайта начала транскрипции. ( E ) Изображены промоторные последовательности дикого типа и мутантные (M1, M2, M3) miR-29a, используемые в D и F .Мутировавшие нуклеотиды показаны серыми буквами. Анализ мотивов выявил консервативный сайт связывания Fos-Jun, удаленный у мутанта 3 (M3). Звездочки указывают на одинаковые нуклеотиды среди видов. ( F ) Активность промотора miR-29a для укороченных (-374 / -278) или мутантных (M3) промоторных конструкций дикого типа после активации передачи сигнала MEK2 (MKK2; n = 6). ( G ) Экспрессия генов указанных факторов транскрипции AP-1 в мышечных трубках C2C12 после обработки рекомбинантным FGF-2 и ингибирования передачи сигнала MEK1 / 2 ( n = 6).( H ) Экспрессия Fosl1 в миобластах C2C12 после сверхэкспрессии Fosl1 ( n = 6). ( I и J ) активность промотора miR-29a для конструкции усеченного промотора (-374/278) после обработки рекомбинантным FGF-2 и / или сверхэкспрессии Fosl1, проводимой в миобластах ( I ) C2C12 или ( J ) первичные миобласты мыши ( n = 6). ( K ) активность промотора miR-29a для конструкции усеченного промотора (-374 / -278) после обработки рекомбинантным FGF-2 и / или нокдауна Fosl1 ( n = 5).( L и M ) Экспрессия L Fosl1 и M miR-29a в первичных мышечных трубках мыши после опосредованной AAV сверхэкспрессии Fosl1 ( n = 6). ( N ) Экспрессия Fosl1 в первичных миобластах мыши после нокдауна Fosl1 ( n = 5). ( O ) Экспрессия miR-29a в первичных миобластах мыши после обработки рекомбинантным FGF-2 и нокдауна Fosl1 ( n = 3). ( P ) ЧИП p-FRA1 на промоторе miR-29a, выполняемый в первичных миобластах человека после обработки рекомбинантным FGF-2 ( n = 4).Обогащение промотора miR-29a оценивали по отношению к общей входящей ДНК с помощью кПЦР и отображали по отношению к отрицательному контролю (IgG). Репрезентативные образцы были визуализированы на агарозном геле ( слева, ). Данные в A – D , F и K были получены на мышечных трубках C2C12 и оценены с помощью нормализованных анализов люциферазы. Значения qPCR в G , H и L — O были нормализованы на snoRNA234 (miR-29a) или 18S рРНК. Все данные представлены как среднее ± стандартная ошибка среднего.Значимость оценивалась с помощью ( A — D , F , I — K , O и P ) одностороннего дисперсионного анализа с тестом множественных сравнений Тьюки, ( G ) двумя двухсторонний дисперсионный анализ с тестом множественных сравнений Тьюки и ( H и L — N ) двусторонний непарный тест Стьюдента t . n.s. = не имеет значения; * P ≤ 0,05; ** P ≤ 0,01; *** P ≤ 0,001.
У старых мышей более высокий уровень TF p-FRA-1.
Затем мы хотели понять, активен ли путь передачи сигналов FGF-2, который мы идентифицировали in vitro, в скелетных мышцах in vivo. Поскольку количество FGF-2 увеличивается в скелетных мышцах во время старения у мышей (28, 29), мы обратились к мышам в возрасте 25 месяцев и сравнили их с мышами в возрасте двух месяцев (молодой контроль). В самом деле, у старых мышей была более высокая экспрессия Fgf2, Fosl1 и miR-29a (Fig. 5 A — C ). Важно отметить, что экспрессия Sparc и уровни циркулирующего SPARC также были ниже у старых мышей (рис.5 D и E ). Более того, мы успешно продемонстрировали, что стареющие скелетные мышцы характеризуются более высокими уровнями фосфорилированного FRA-1 и что связывание FRA-1 с промотором miR-29a значительно увеличивается у старых мышей по сравнению с молодыми, как показал анализ ChIP (рис. 5 F). и G ). Важно отметить, что FAP, выделенные от старых мышей, сохраняли аналогичную чувствительность к SPARC-индуцированному ингибированию адипогенеза по сравнению с FAP, выделенными от молодых мышей ( SI Приложение , рис.S5), указывая на то, что снижение уровней Sparc, которое мы наблюдали в скелетных мышцах старых мышей, может иметь отношение к FAP. Мы пришли к выводу, что ось FGF-2 / FRA-1 / miR-29a / SPARC последовательно регулируется in vivo в старых скелетных мышцах мышей и может влиять на связанный со старением IMAT.
Рис. 5.Старые скелетные мышцы содержат повышенные уровни p-FRA-1, которые опосредуют подавление Sparc с помощью miR-29a. Экспрессия ( A ) Fgf2, ( B ) Fosl1, ( C ) miR-29a и ( D ) Sparc у 2-месячных (молодых) по сравнению с 25-месячными (пожилыми) мышей передняя большеберцовая мышца ( n = 6).Значения qPCR были нормализованы до Tbp или snoRNA234 (miR-29a). ( E ) Уровни циркулирующих уровней SPARC у молодых и старых мышей по оценке с помощью иммуноферментного анализа ( n = 5 против 4). ( F ) Иммуноблот, отображающий фосфорилирование FRA-1 в молодых и старых мышцах большеберцовой мышцы мышей ( n = 4). Плотность полос определяли количественно и нормализовали по GAPDH. ( G ) ЧИП p-FRA1 на промоторе miR-29a, выполненный в икроножной мышце молодых и старых мышей ( n = 6).Обогащение промотора miR-29a оценивали по отношению к общей входящей ДНК с помощью кПЦР и отображали по отношению к отрицательному контролю (IgG). Репрезентативные образцы были визуализированы на агарозном геле ( слева, ). Все данные представлены как среднее ± стандартная ошибка среднего. Значимость оценивали с помощью ( A — F ) двустороннего непарного теста Стьюдента t и ( G ) одностороннего дисперсионного анализа ANOVA с тестом множественных сравнений Тьюки. * P ≤ 0,05; ** P ≤ 0,01; *** P ≤ 0.001.
FGF-2 и SPARC регулируют создание IMAT.
Чтобы продемонстрировать функцию оси FGF-2 / SPARC как регулятора дифференцировки адипоцитов in vivo, мы использовали глицериновую модель регенерации мышц, в которой можно легко наблюдать жировую инфильтрацию (20), в отличие от других моделей мышей, таких как атрофия денервации (30–33) или раковая кахексия (34–37). С этой целью мы вводили Fgf2 или Sparc-сверхэкспрессирующий AAV 9 непосредственно в переднюю большеберцовую мышцу мышей, как описано ранее (38–42).Ожидается, что при таком подходе будут инфицированы волокна как 1-го, так и 2-го типа, но не взрослые мышечные стволовые клетки (42). Через 3 недели регенерацию мышц и жировую инфильтрацию вызывали с помощью однократной инъекции глицерина, а через 2 недели мышцы анализировали на инфильтрацию адипоцитов (фиг. 6 A ). AAV-Fgf2 индуцировал экспрессию Fgf2 и увеличивал мышечную массу (фиг. 6 B и C ). Важно отметить, что образование IMAT резко индуцировалось в парафиновых срезах из AAV-Fgf2 по сравнению с мышцами, инъецированными AAV-GFP, где площадь IMAT и общее количество адипоцитов были значительно увеличены в 12 и 9 раз, соответственно (рис.6 F ). Соответственно, на молекулярном уровне, связывающий жирные кислоты белок 4 (Fabp4) и гамма-рецептор, активируемый пролифератором пероксисом (Pparg), были значительно повышены (Fig. 6 D и E ). Поразительно, что сверхэкспрессия Sparc с использованием того же подхода AAV (Fig. 6 G ) приводила к противоположному эффекту. Образование IMAT и общее количество адипоцитов были значительно уменьшены более чем на 50% с AAV-Sparc по сравнению с вирусом AAV-GFP (фиг. 6 J ).Это уменьшение инфильтрации адипоцитов сопровождалось значительным снижением экспрессии маркеров адипоцитов Fabp4 и Pparg (фиг. 6 H и I ). Интересно, что количество FAP изменилось в том же направлении, что и IMAT, после введения как AAV-Fgf2, так и AAV-Sparc ( SI Приложение , рис. S6 A – F ), но эти эффекты были более тонкими и вряд ли объясняют выраженный эффекты, которые мы наблюдали для формирования IMAT. Мы пришли к выводу, что ось FGF-2 / SPARC регулирует дифференцировку FAP in vitro и образование IMAT in vivo (см.рис.7). Важно, что AAV-Sparc также снижает IMAT у старых мышей ( SI Приложение , Fig. S6, G – J ), обеспечивая дополнительную поддержку роли FGF-2 / SPARC в связанном со старением IMAT.
Рис. 6.FGF-2 и SPARC являются регуляторами формирования IMAT. ( A ) Экспериментальный обзор внутримышечных (в / м) инъекций AAV9. ( B ) Относительный вес ткани и экспрессия ( C ) Fgf2, ( D ) Fabp4 и ( E ) Pparg в AAV-Fgf2-инфицированной передней большеберцовой мышце через 2 недели после инъекции глицерина ( n = 7 против 6).Значения qPCR были нормализованы к 18S рибосомной РНК (рРНК). ( F и J ) Образование IMAT при репрезентативном окрашивании гематоксилином и эозином поперечных срезов в ( F ) AAV-Fgf2– ( n = 7 против 6) или ( J ) AAV-Sparc– ( n = 4 против 5) инфицированная передняя большеберцовая мышца через 2 недели после инъекции глицерина и анализа относительной площади IMAT и количества адипоцитов. (Шкала, 0,5 мм, верхний ; 100 мкм, нижний .) ( G ) Sparc, ( H ) Fabp4 и ( I ) экспрессия Pparg в AAV-Sparc-инфицированной передней большеберцовой мышце Через 2 недели после инъекции глицерина ( n = 6 против 6 против 5).Значения qPCR были нормализованы до 18S рРНК. Все данные представлены как среднее ± стандартная ошибка среднего. Значимость оценивали с помощью ( B — F и J ) двустороннего непарного теста Стьюдента t и ( G — I ) одностороннего дисперсионного анализа ANOVA с тестом множественных сравнений Тьюки. * P ≤ 0,05; ** P ≤ 0,01; *** P ≤ 0,001.
Рис. 7.Сигнальный путь FGF-2 способствует внутримышечному адипогенезу в старых скелетных мышцах. Связывание фактора роста фибробластов-2 (FGF-2) фосфорилирует внутриклеточный тирозинкиназный домен рецептора фактора роста фибробластов (FGFR), который активирует внутриклеточные сигнальные пути, включая киназу MAPK / ERK 1/2 (MEK1 / 2), для фосфорилирования внеклеточного сигнала. регулируемые киназы (ERK1 / 2; p44 / 42 MAPK).Активность MAPK увеличивает как количество Fosl1, так и трансактивирующую способность гетеродимера Fos-Jun. Фосфорилирование Fos-родственного антигена (FRA-1) усиливает его связывание с участком связывания ДНК активаторного белка-1 (AP-1), расположенным в промоторе miR-29a, для стимуляции транскрипции. В старых скелетных мышцах усиленная передача сигналов FGF-2 увеличивает уровни фосфорилированного FRA-1, что, в свою очередь, способствует экспрессии miR-29a. Повышенные уровни miR-29a стимулируют дифференцировку FAP в адипоциты за счет уменьшения SPARC, способствуя образованию IMAT.
FGF-2-зависимая передача сигналов активируется в скелетных мышцах пожилого человека.
Наконец, мы спросили, активируется ли зависимый от FGF-2 сигнальный путь, который регулирует SPARC, также в старых скелетных мышцах людей (характеристики пациентов в SI Приложение ). Как и в старых скелетных мышцах мышей, в старых мышцах человека экспрессия miR-29a была значительно повышена, в то время как его целевой ген SPARC был значительно подавлен по сравнению с мышцами молодого человека (рис.8 C и D ). Хотя повышающая регуляция FGF2 и FOSL1 не достигла статистической значимости (фиг.8 A и B ), экспрессия FGF-2 в скелетных мышцах положительно коррелировала с возрастом и уровнями FOSL1 (фиг.8 G и ). H ). По сравнению с молодым контролем, инфильтрация IMAT в скелетные мышцы пожилого человека была значительно увеличена в четыре раза на парафиновых срезах (рис.8 I ), а экспрессия маркера адипоцитов FABP4 была значительно индуцирована (рис.8 E ). Вместе наши результаты предоставляют доказательства того, что зависимый от FGF-2 сигнальный путь, который вызывает индукцию miR-29a и подавление SPARC, сохраняется у мышей и людей и связан с увеличением IMAT в скелетных мышцах человека.
Рис. 8.В скелетных мышцах пожилого человека наблюдаются пониженные уровни SPARC и повышенное образование IMAT. Экспрессия ( A ) FGF2, ( B ) FOSL1, ( C ) miR-29a, ( D ) SPARC, ( E ) FABP4 и ( F ) PPARG у молодых (<55 y; n = 5) по сравнению с возрастом (> 75 лет; n = 6) Tensor fasciae latae.Значения qPCR были нормализованы к 18S рибосомной РНК или малой ядерной РНК U6 (miR-29a). ( G и H ) Корреляция Пирсона и линия линейной регрессии между возрастом ( G ) по сравнению с экспрессией мРНК FGF2 и ( H ) FGF2 по сравнению с экспрессией мРНК FOSL1 в мышцах Tensor fasiae latae молодых и пожилых доноров ( n = 11). ( I ) Образование IMAT при репрезентативном окрашивании гематоксилином и эозином поперечных срезов молодых и старых мышц Tensor fasiae latae.Внутримышечные адипоциты обозначены красными стрелками. (Масштабная шкала, 200 мкм.) Относительную площадь IMAT определяли количественно в двух последовательных срезах, полученных из двух разных областей на донора ( n = 5). Все данные представлены как среднее ± стандартная ошибка среднего. Значимость оценивалась с помощью ( A — F и I ) двустороннего непарного теста Стьюдента t и ( G и H ) коэффициентов корреляции Пирсона. * P ≤ 0,05.
Обсуждение
FGF-2 является критическим фактором роста миогенных клеток-предшественников (MPs) в нише взрослых мышечных стволовых клеток.Здесь мы сообщаем о связи между формированием FGF-2 и IMAT. Наши результаты показывают две противоположные роли FGF-2 с положительным или отрицательным действием на скелетные мышцы, стимуляцию роста мышц, с одной стороны, и увеличение IMAT, с другой. Нацеливание на адипогенную ось передачи сигналов FGF-2 может улучшить функцию и предотвратить неблагоприятные исходы, связанные со старыми скелетными мышцами.
Передача сигналов FGF-2 в скелетных мышцах человека изучена недостаточно (43). Наши данные дают представление о влиянии старения на FGF-2.Мы показываем, что экспрессия FGF-2 в скелетных мышцах человека положительно коррелирует со старением и что старение влияет на экспрессию miR-29a и SPARC, двух сигнальных молекул ниже FGF-2. В мышцах FGF-2 секретируется как MP (44), так и взрослыми миофибриллами (28, 45) во внеклеточный матрикс скелетных мышц (46) и преимущественно влияет на пролиферацию MP. Фактически, ингибирование передачи сигналов FGF-2 индуцировало дифференцировку MPs и уменьшало мышечную массу (47). Кроме того, FGF-2 может способствовать формированию сосудов (48), поскольку доставка гена FGF-2 к иссеченным мышечным ранам усиливает не только образование регенерирующих мышечных трубок, но и ангиогенез (49).Наши результаты идентифицируют FAP как третью популяцию клеток, которые получают пользу от FGF-2 во время мышечного повреждения. Роль передачи сигналов FGF-2 во время адипогенеза в классических жировых депо дает противоречивые результаты. FGF-2 усиливает адипогенез в мезенхимальных стволовых клетках (50). Кроме того, активация передачи сигналов p44 / 42 MAPK инициирует дифференцировку в преадипоцитах (51), хотя фосфорилирование PPAR-γ с помощью MAPK предотвращает окончательное созревание адипоцитов (52). FGF-2 ингибировал адипогенез стромальных клеток костного мозга человека (53), а нарушение FGF-2 активировало адипогенную программу в мезенхимальных стромальных клетках костного мозга (54).Дифференциальные эффекты FGF-2 для классической WAT могут отражать двухфазный эффект, зависящий от концентрации (55).
Мы определили SPARC как связь между образованием FGF-2 и IMAT в скелетных мышцах. Мы используем несколько стратегий, чтобы продемонстрировать, что SPARC является прямой мишенью для miR-29a и что эта взаимосвязь сохраняется у разных видов. Экспрессия SPARC усиливается, когда передача сигналов FGF-2 / MEK1 / 2 ингибируется как в мышиных, так и в человеческих первичных мышечных клетках. Более того, геномные мутации в SPARC 3 ‘UTR устраняют FGF-2, а также miR-29a-опосредованную репрессию, увеличивают секрецию SPARC и ингибируют дифференцировку FAP в системах совместного культивирования.Наши результаты согласуются с ролью SPARC в классическом депо белого жира, в котором SPARC участвует в ингибировании дифференцировки белых адипоцитов (56–58). Sparc-нулевые мыши имеют более крупные подкожные и эпидидимальные жировые подушечки (56). SPARC — это связанный с матриксом гликопротеин, который вызывает изменения формы клеток, подавляет развитие клеточного цикла и влияет на синтез внеклеточного матрикса (56, 59). Механизмы SPARC, включающие адипогенез, включают ремоделирование внеклеточного матрикса за счет увеличения отложения фибронектина и экспрессии его рецептора α5-интегрина или ингибирования экспрессии ламинина и его рецептора α6-интегрина (57).Более того, было показано, что SPARC способствует накоплению β-катенина (57), который ингибирует активность PPAR-γ (60). Интересно, что упражнения стимулируют экспрессию SPARC в скелетных мышцах человека и мышей (23). Таким образом, наши данные могут иметь клиническое значение для стратегий предотвращения образования IMAT, например, для разработки протоколов упражнений, направленных на максимальное увеличение уровней SPARC в мышечной ткани. Уже было показано, что легкие или более интенсивные упражнения увеличивают экспрессию SPARC в скелетных мышцах у пожилых людей (61, 62).Хотя влияние SPARC на IMAT поразительно, о влиянии SPARC на регенерацию мышц известно меньше. После избыточной экспрессии SPARC в скелетных мышцах мы отметили небольшое уменьшение количества волокон и сдвиг в сторону меньших диаметров волокон ( SI Приложение , Fig. S7 A – C ), но значение этих эффектов требует дальнейшего изучения.
Также важно отметить, что не только зрелые миофибриллы, но также МП и другие типы клеток могут быть важным источником SPARC в скелетных мышцах.Мы интерпретируем отсутствие эффекта на мРНК Sparc в лизатах цельных мышц в модели Acta1-CreER как результат недостижения биологического порога регуляции Sparc с помощью miR-29a в миофибриллах. Однако альтернативным объяснением может быть то, что в конститутивной модели Pax7-Cre делеция miR-29a в MPs вносит вклад в увеличение Sparc. Панели тканей подтверждают, что miR-29a и Sparc также экспрессируются в MPs и FAP ( SI, приложение , рис. S7, D и E ), но в меньшей степени по сравнению с цельномышечной тканью.Кроме того, мы ранее сообщали, что miR-29a составляет 0,1% всех miRNAs в MPs, но 0,75% всех miRNAs в передней большеберцовой мышце (24, 63). Эти данные подтверждают гипотезу о пороге miR-29a для регуляции Sparc в зрелых миофибриллах. В любом случае, независимо от потенциальных источников Sparc, повышающая регуляция Sparc в модели Pax7-Cre демонстрирует, что миогенная линия является важным фактором экспрессии Sparc в скелетных мышцах.
Старение связано с уменьшением количества МП (64) и потерей их способности сохранять состояние покоя (28).Миофибры являются основным источником FGF-2 для ниши сателлитных клеток. Безудержная экспрессия FGF-2 в мышиных миофибриллах предполагает, что они являются основными участниками истощения стволовых клеток во время старения (28, 29). Причина увеличения FGF-2 в старых скелетных мышцах неизвестна, но может отражать неудачную попытку восстановить старые мышцы. Действительно, активация FGF / p38 MAPK была продемонстрирована в старых сателлитных клетках (65). Более того, гены-мишени FGF-2 p21 и p16 более эпигенетически подавлены в молодых, чем в старых стволовых клетках (29).Передача сигналов FGF сложна и зависит от доступности не только FGF-2, но также корецепторов и компонентов внеклеточного матрикса, таких как синдекан-4, β1-интегрин и фибронектин (26, 65). Кроме того, динамические изменения уровней сульфатирования сульфата гепарина увеличивают передачу сигналов FGF-2 в старых скелетных мышцах (66). Идентификация точных сигнальных событий FGF-2 в старых скелетных мышцах в нашем исследовании должна помочь в точной оценке сигнальной способности FGF-2 не только во время старения, но и при других клинически значимых патологиях, таких как ожирение или атрофия мышц, при которых FGF-2 О сигнальных событиях пока не сообщалось.Выраженная гетерогенность ткани может создавать ограничения для использования массового анализа передачи сигналов FGF-2 в мышечных образцах in vivo. В то время как AAV-Fgf2 индуцировал miR-29a и снижал уровни Sparc, как ожидалось в первичных мышечных трубках in vitro ( SI Приложение , рис. S7 F – I ), мы не наблюдали такой же корреляции в наших мышечных образцах на 35-й день после Впрыск AAV-Fgf2 ( SI Приложение , Рис. S7 J – L ). Обильная жировая инфильтрация может потребовать лучшего пространственного разрешения анализа экспрессии генов.В самом деле, уровни miR-29a и Sparc различаются между мышечной тканью и классическими белыми жировыми отложениями ( SI Приложение , Fig. S7, M и N ), тогда как их экспрессия во внутримышечных адипоцитах все еще неизвестна.
С помощью классических экспериментов по анализу промоторов и биоинформатики мы идентифицировали сайт связывания AP-1 на промоторе miR-29a и TF FRA-1 как эффектор. FRA-1 — это TF, который реагирует на лечение FGF-2, а также MEK1 / 2. Манипуляции с FGF-2 / MEK1 / 2 приводили к регуляции FRA-1 и miR-29a.Наши результаты дают представление о роли AP-1 в скелетных мышцах взрослых. Предыдущие исследования были сосредоточены на его роли во время дифференцировки мышечных клеток, в которой c-jun и MyoD могут координировать факторы мышечных энхансеров (67), а сайты AP-1 могут иметь общие гены-мишени с MEF2 (68). Экспрессия FRA-1 снижается во время дифференцировки C2C12 (68) в соответствии со снижением экспрессии miR-29a (22). Роль AP-1 в скелетных мышцах взрослых подтверждается данными о том, что экспрессия членов AP-1 в скелетных мышцах человека увеличивается после тренировки, при этом наибольшая регуляция наблюдается для FOSL1 (69).Кроме того, на мышиной модели мышечной атрофии связывание FRA-1 с промотором MMP-2 увеличилось в четыре раза (70). Наши результаты показывают, что FRA-1 может быть важным компонентом реакции скелетных мышц во время старения.
Недифференцированные пролиферирующие FAP необходимы для успешной регенерации мышц (71). Соответственно, FAP нельзя просто стереть, чтобы предотвратить IMAT. Следовательно, необходимы стратегии, которые могут модулировать судьбу FAP и их склонность к дифференцировке в адипоциты при болезненных состояниях.Внеклеточный матрикс (ECM), по-видимому, является важным медиатором клеточной судьбы FAP. В модели мышечной дистрофии пояса конечностей 2B на мышах прогрессивное накопление аннексина A2 в ЕСМ миофибрилл способствует дифференцировке FAP в адипоциты, в то время как недостаток аннексина A2 предотвращает адипогенез FAP (72). Кроме того, было показано, что врожденная иммунная система 2 типа регулирует FAP. Секреция Il4 / Il13 из эозинофилов может активировать пролиферацию FAP, а инъекции Il4 во время индуцированной глицерином регенерации мышц снижают образование адипоцитов (73).Решение судьбы ФАПов кажется многообещающей стратегией предотвращения образования IMAT. Таким образом, секретируемые факторы, такие как SPARC, представляют собой важные терапевтические мишени.
На сегодняшний день регулирование формирования IMAT недостаточно изучено. Связывание сигнальных путей фактора роста с плейотропными эффектами miRNAs на секрецию миокинов и дифференцировку FAP может предоставить новые диагностические и терапевтические подходы. Раннее обнаружение повышенного риска IMAT на основе оси FGF-2 / FRA-1 / miR-29a / SPARC и его использование для улучшения дегенерации жировых мышц может помочь предотвратить IMAT и ее последствия, потерю мышечной массы и функцию в старшее население.
Материалы и методы
Подробная информация о людях и полных процедурах экспериментов на животных, подготовка клеток, сортировка клеток с активацией флуоресценции, культура клеток, экстракция РНК, синтез комплементарной ДНК, qRT-PCR, анализ пролиферации, иммуноферментный анализ , конструирование плазмиды, анализ люциферазы, редактирование генома CRISPR-Cas9, продуцирование AAV, ChIP, экстракция белка, вестерн-блоттинг, гистология, LC-MS / MS, секвенирование РНК, биоинформатика и статистический анализ представлены в приложении SI .
Доступность данных
Мы заявляем, что все данные, подтверждающие выводы этого исследования, доступны в статье и приложении SI к ней и депонированы в Dryad (DOI: 10.5061 / dryad.j6q573nf6) (74). Данные о секвенировании РНК, описанные в этом отчете, депонированы в базе данных Gene Expression Omnibus (GSE154254) (75). Данные масс-спектрометрической протеомики были депонированы в консорциум ProteomeXchange через партнерский репозиторий Proteomics Identifications Database (PRIDE) с идентификатором набора данных PXD020575 (76).
Благодарности
Это исследование было поддержано грантом Швейцарского NSF (182716) J.K. и неограниченные гранты от фондов Vontobel, Philhuman, Heuberg и Uniscientia для J.K. Мы благодарим доктора Эдлиру Луку за критическое прочтение рукописи. Мы также благодарим Центр функциональной геномики в Цюрихе, Центр проточной цитометрии в Цюрихе и сотрудников Wolfrum Lab за их техническую поддержку.
Сноски
Вклад авторов: С.М. и Дж. К. спланированное исследование; С.М. и А.Ф. провели исследования; C.W. предоставил новые реагенты / аналитические инструменты; С.М., А.Ф., У.Г., Дж.К. проанализированные данные; С.М. и J.K. написал статью; и H.A.R. и М. набирали пациентов и проводили биопсию мышц.
Авторы заявляют об отсутствии конкурирующей заинтересованности.
Эта статья представляет собой прямое представление PNAS.
Эта статья содержит вспомогательную информацию в Интернете по адресу https://www.pnas.org/lookup/suppl/doi:10.1073 / pnas.2021013118 / — / DCSupplemental.
- Авторские права © 2021 Автор (ы). Опубликовано PNAS.
Мышечная система — Мышцы человеческого тела
Нажмите, чтобы просмотреть большое изображение
Продолжение сверху …Анатомия мышечной системы
Типы мышц
Существует три типа мышечной ткани: висцеральная, сердечная и скелетная.
Висцеральные мышцы
Висцеральные мышцы находятся внутри таких органов, как желудок, , кишечник и кровеносные сосуды. Самая слабая из всех мышечных тканей, висцеральная мышца заставляет органы сокращаться для перемещения веществ через орган. Поскольку висцеральные мышцы контролируются бессознательной частью мозга, они известны как непроизвольные мышцы — они не могут напрямую контролироваться сознанием. Термин «гладкая мышца» часто используется для описания висцеральной мышцы, потому что она имеет очень гладкий, однородный вид при просмотре под микроскопом.Этот гладкий вид резко контрастирует с полосатым внешним видом сердечных и скелетных мышц.
Сердечная мышца
Обнаружен только в сердце . Сердечная мышца отвечает за перекачивание крови по всему телу. Тканью сердечной мышцы нельзя управлять сознательно, поэтому это непроизвольная мышца. В то время как гормоны и сигналы от мозга регулируют скорость сокращения, сердечная мышца стимулирует себя к сокращению. Естественный кардиостимулятор сердца состоит из ткани сердечной мышцы, которая стимулирует сокращение других клеток сердечной мышцы.Считается, что сердечная мышца из-за своей самостимуляции является ауторитмичной или внутренне контролируемой.
Клетки сердечной мышечной ткани имеют поперечно-полосатую окраску, то есть кажутся светлыми и темными полосами при просмотре под световым микроскопом. Расположение белковых волокон внутри клеток вызывает появление этих светлых и темных полос. Штрихи указывают на то, что мышечная клетка очень сильная, в отличие от висцеральных мышц.
Клетки сердечной мышцы представляют собой разветвленные клетки X- или Y-формы, плотно связанные между собой специальными соединениями, называемыми вставными дисками.Вставные диски состоят из пальцевидных выступов двух соседних клеток, которые сцепляются и обеспечивают прочную связь между клетками. Разветвленная структура и вставные диски позволяют мышечным клеткам противостоять высокому кровяному давлению и перекачке крови на протяжении всей жизни. Эти функции также помогают быстро распространять электрохимические сигналы от клетки к клетке, чтобы сердце могло биться как единое целое.
Скелетные мышцы
Скелетная мышца — единственная произвольная мышечная ткань в человеческом теле — она контролируется сознательно.Каждое физическое действие, которое человек сознательно выполняет (например, речь, ходьба или письмо), требует скелетных мышц. Функция скелетных мышц заключается в сокращении для перемещения частей тела ближе к кости, к которой прикреплена мышца. Большинство скелетных мышц прикреплены к двум костям через сустав, поэтому мышца служит для перемещения частей этих костей ближе друг к другу.
Клетки скелетных мышц образуются, когда множество более мелких клеток-предшественников сливаются вместе, образуя длинные, прямые, многоядерные волокна.Эти волокна скелетных мышц имеют очень сильную поперечно-полосатую форму, как и сердечная мышца. Скелетная мышца получила свое название от того факта, что эти мышцы всегда соединяются со скелетом по крайней мере в одном месте.
Макроскопическая анатомия скелетных мышц
Большинство скелетных мышц прикреплены к двум костям через сухожилия. Сухожилия — это жесткие полосы плотной регулярной соединительной ткани, сильные коллагеновые волокна которой прочно прикрепляют мышцы к костям. Сухожилия подвергаются сильному стрессу, когда на них тянутся мышцы, поэтому они очень сильны и вплетены в оболочку как мышц, так и костей.
Мышцы двигаются, укорачивая свою длину, растягивая сухожилия и приближая кости друг к другу. Одна из костей тянется к другой кости, которая остается неподвижной. Место на неподвижной кости, которое через сухожилия соединяется с мышцей, называется исходной точкой. Место на движущейся кости, которое соединяется с мышцей посредством сухожилий, называется прикреплением. Брюшко мышцы — это мясистая часть мышцы между сухожилиями, которая действительно сокращается.
Названия скелетных мышц
Названия скелетных мышц основаны на множестве различных факторов, включая их расположение, происхождение и прикрепление, количество источников, форму, размер, направление и функцию.
- Расположение . Многие мышцы получили свое название от анатомической области. Прямые мышцы живота и поперечные мышцы живота, например, находятся в области брюшной полости . Некоторые мышцы, такие как tibialis anterior , названы в честь части кости (передняя часть большеберцовой кости ), к которой они прикреплены.Другие мышцы используют гибрид этих двух, например, brachioradialis, названный в честь области (плечевой) и кости ( радиус ).
- Происхождение и размещение . Названия некоторых мышц основаны на их соединении с неподвижной костью (происхождение) и подвижной костью (прикрепление). Эти мышцы очень легко идентифицировать, если вы знаете названия костей, к которым они прикреплены. Примеры этого типа мышц включают грудинно-ключично-сосцевидную мышцу (соединяющую грудину и ключицу с сосцевидным отростком черепа) и затылочно-лобную кость (соединяющую затылочную кость с лобной костью ).
- Количество источников . Некоторые мышцы соединяются более чем с одной костью или с более чем одним местом на кости и, следовательно, имеют более одного происхождения. Мышца с двумя источниками называется бицепс. Мышца с тремя источниками — это трехглавая мышца. Наконец, мышца с четырьмя источниками — четырехглавая мышца.
- Форма, размер и направление . Мы также классифицируем мышцы по их форме. Например, дельтоиды имеют дельтовидную или треугольную форму. Зубчатые мышцы имеют зубчатую или пилообразную форму.Большой ромбовидный элемент имеет форму ромба или ромба. Размер мышцы можно использовать для различения двух мышц, находящихся в одной и той же области. Ягодичная область состоит из трех мышц, различающихся по размеру: большая ягодичная мышца (большая), средняя ягодичная мышца (средняя) и минимальная ягодичная мышца (самая маленькая). Наконец, направление движения мышечных волокон можно использовать для идентификации мышцы. В области живота есть несколько наборов широких плоских мышц. Мышцы, волокна которых проходят прямо вверх и вниз, — это rectus abdominis , те, которые проходят поперечно (слева направо), — это поперечные мышцы живота, а те, которые идут под углом, — это косые мышцы живота.
- Функция . Иногда мышцы классифицируют по типу выполняемой ими функции. Большинство мышц предплечий названы в зависимости от их функции, потому что они расположены в одной области и имеют схожие формы и размеры. Например, группа сгибателей предплечья сгибает запястье и пальцы. Супинатор — это мышца, которая поддерживает запястье, переворачивая его ладонью вверх. В ноге есть мышцы, называемые аддукторами, роль которых состоит в том, чтобы сводить (стягивать) ноги.
Действие групп в скелетных мышцах
Скелетные мышцы редко работают сами по себе для выполнения движений тела. Чаще они работают в группах, чтобы производить точные движения. Мышца, которая производит какое-либо конкретное движение тела, известна как агонист или первичный двигатель. Агонист всегда соединяется с мышцей-антагонистом, которая оказывает противоположный эффект на одни и те же кости. Например, двуглавая мышца плеча сгибает руку в локте . Как антагонист этого движения, трехглавая мышца плеча разгибает руку в локте.Когда трицепс разгибает руку, бицепс считается антагонистом.
Помимо пары агонист / антагонист, другие мышцы работают, чтобы поддерживать движения агониста. Синергисты — это мышцы, которые помогают стабилизировать движение и уменьшить посторонние движения. Обычно они обнаруживаются в регионах рядом с агонистом и часто соединяются с одними и теми же костями. Поскольку скелетные мышцы перемещают вставку ближе к неподвижной точке начала, фиксирующие мышцы помогают перемещению, удерживая исходную точку стабильной.Если вы поднимаете что-то тяжелое руками, фиксаторы в области туловища удерживают ваше тело в вертикальном и неподвижном положении, чтобы вы сохраняли равновесие во время подъема.
Гистология скелетных мышц
Волокна скелетных мышц резко отличаются от других тканей тела из-за их узкоспециализированных функций. Многие органеллы, из которых состоят мышечные волокна, уникальны для этого типа клеток.
Сарколемма — клеточная мембрана мышечных волокон. Сарколемма действует как проводник электрохимических сигналов, стимулирующих мышечные клетки.К сарколемме подключены поперечные канальцы (Т-канальцы), которые помогают переносить эти электрохимические сигналы в середину мышечного волокна. Саркоплазматический ретикулум служит хранилищем ионов кальция (Ca2 +), которые жизненно важны для сокращения мышц. Митохондрии, «энергетические дома» клетки, изобилуют мышечными клетками, которые расщепляют сахара и обеспечивают энергией в форме АТФ активные мышцы. Большая часть структуры мышечных волокон состоит из миофибрилл, которые являются сократительными структурами клетки.Миофибриллы состоят из множества белковых волокон, организованных в повторяющиеся субъединицы, называемые саркомерами. Саркомер — функциональная единица мышечных волокон. (См. Макронутриенты для получения дополнительной информации о роли сахаров и белков.)
Структура саркомера
Саркомеры состоят из двух типов белковых волокон: толстых и тонких.
Физиология мышечной системы
Функция мышечной ткани
Основная функция мышечной системы — движение.Мышцы — единственная ткань в теле, которая имеет способность сокращаться и, следовательно, перемещать другие части тела.
С функцией движения связана вторая функция мышечной системы: поддержание осанки и положения тела. Мышцы часто сокращаются, чтобы удерживать тело неподвижно или в определенном положении, а не для движения. Мышцы, отвечающие за осанку, обладают наибольшей выносливостью из всех мышц тела — они поддерживают тело в течение дня, не уставая.
Другая функция, связанная с движением, — это движение веществ внутри тела. Сердечные и висцеральные мышцы в первую очередь отвечают за транспортировку таких веществ, как кровь или пища, из одной части тела в другую.
Последняя функция мышечной ткани — это выработка тепла телом. В результате высокой скорости метаболизма сокращающихся мышц наша мышечная система вырабатывает много тепла. Многие небольшие сокращения мышц внутри тела производят естественное тепло нашего тела.Когда мы напрягаемся больше, чем обычно, дополнительные сокращения мышц приводят к повышению температуры тела и, в конечном итоге, к потоотделению.
Скелетные мышцы как рычаги
Скелетные мышцы работают вместе с костями и суставами, образуя рычажные системы. Мышца действует как сила усилия; сустав действует как точка опоры; кость, которую двигает мышца, действует как рычаг; и перемещаемый объект действует как нагрузка.
Существует три класса рычагов, но подавляющее большинство рычагов в корпусе являются рычагами третьего класса.Рычаг третьего класса — это система, в которой точка опоры находится на конце рычага, а усилие — между точкой опоры и грузом на другом конце рычага. Рычаги третьего класса в теле служат для увеличения расстояния, на которое перемещается нагрузка, по сравнению с расстоянием, на которое сокращается мышца.
Компромисс для этого увеличения расстояния заключается в том, что сила, необходимая для перемещения груза, должна быть больше, чем масса груза. Например, двуглавая мышца плеча руки натягивает радиус предплечья, вызывая сгибание в локтевом суставе в рычажной системе третьего класса.Очень небольшое изменение длины бицепса вызывает гораздо большее движение предплечья и кисти, но сила, прикладываемая бицепсом, должна быть выше, чем нагрузка, перемещаемая мышцей.
Моторные агрегаты
Нервные клетки, называемые мотонейронами, контролируют скелетные мышцы. Каждый двигательный нейрон контролирует несколько мышечных клеток в группе, известной как двигательная единица. Когда мотонейрон получает сигнал от мозга, он одновременно стимулирует все мышечные клетки своей двигательной единицы.
Размер двигательных единиц варьируется по всему телу в зависимости от функции мышцы. Мышцы, которые выполняют тонкие движения, такие как глаза, или пальцы, имеют очень мало мышечных волокон в каждой двигательной единице, чтобы повысить точность контроля мозга над этими структурами. Мышцы, которым для выполнения своих функций требуется большая сила, такие как мышцы ног или рук, имеют множество мышечных клеток в каждой двигательной единице. Один из способов, которыми тело может контролировать силу каждой мышцы, — это определение того, сколько двигательных единиц активировать для данной функции.Это объясняет, почему те же мышцы, которые используются для взятия карандаша, используются и для взятия шара для боулинга.
Цикл сокращения
Мышцы сокращаются под действием сигналов от их мотонейронов. Моторные нейроны контактируют с мышечными клетками в точке, называемой нервно-мышечным соединением (НМС). Моторные нейроны выделяют химические вещества-нейротрансмиттеры в НМС, которые связываются со специальной частью сарколеммы, известной как моторная концевая пластинка. Концевая пластина двигателя содержит множество ионных каналов, которые открываются в ответ на нейротрансмиттеры и позволяют положительным ионам проникать в мышечные волокна.Положительные ионы образуют электрохимический градиент внутри клетки, который распространяется по сарколемме и Т-канальцам, открывая еще больше ионных каналов.
Когда положительные ионы достигают саркоплазматической сети, ионы Ca2 + высвобождаются и позволяют проникать в миофибриллы. Ионы Ca2 + связываются с тропонином, что заставляет молекулу тропонина изменять форму и перемещать соседние молекулы тропомиозина. Тропомиозин перемещается от участков связывания миозина на молекулах актина, позволяя актину и миозину связываться вместе.
молекул АТФ заставляют белки миозина в толстых филаментах изгибаться и притягивать молекулы актина в тонких филаментах. Белки миозина действуют как весла на лодке, притягивая тонкие волокна ближе к центру саркомера. По мере того как тонкие нити стягиваются вместе, саркомер укорачивается и сжимается. Миофибриллы мышечных волокон состоят из множества саркомеров в ряд, поэтому, когда все саркомеры сокращаются, мышечные клетки укорачиваются с большой силой относительно их размера.
Мышцы продолжают сокращаться, пока они стимулируются нейромедиатором.Когда двигательный нейрон прекращает высвобождение нейротрансмиттера, процесс сокращения меняется на противоположный. Кальций возвращается в саркоплазматический ретикулум; тропонин и тропомиозин возвращаются в исходное положение; предотвращается связывание актина и миозина. Саркомеры возвращаются в свое удлиненное состояние покоя, как только действие миозина на актин прекращается.
Определенные состояния или расстройства, такие как миоклонус, могут влиять на нормальное сокращение мышц. Вы можете узнать о проблемах со здоровьем опорно-двигательного аппарата в нашем разделе, посвященном заболеваниям и состояниям.Кроме того, узнайте больше о достижениях в области тестирования ДНК, которые помогают нам понять генетический риск развития первичной дистонии с ранним началом.
Типы мышечных сокращений
Силой сокращения мышцы можно управлять с помощью двух факторов: количества двигательных единиц, участвующих в сокращении, и количества стимулов со стороны нервной системы. Одиночный нервный импульс двигательного нейрона заставляет двигательную единицу кратковременно сокращаться, прежде чем расслабиться. Это небольшое сокращение известно как сокращение подергивания.Если двигательный нейрон подает несколько сигналов в течение короткого периода времени, сила и продолжительность сокращения мышц увеличиваются. Это явление известно как временное суммирование. Если двигательный нейрон подает множество нервных импульсов в быстрой последовательности, мышца может перейти в состояние столбняка или полного и продолжительного сокращения. Мышца будет оставаться в состоянии столбняка до тех пор, пока скорость нервного сигнала не снизится или пока мышца не станет слишком утомленной, чтобы поддерживать столбняк.
Не все сокращения мышц вызывают движение.Изометрические сокращения — это легкие сокращения, которые увеличивают напряжение в мышце без приложения силы, достаточной для движения части тела. Когда люди напрягают свое тело из-за стресса, они выполняют изометрическое сокращение. Удержание объекта в неподвижном состоянии и сохранение осанки также являются результатом изометрических сокращений. Сокращение, которое действительно вызывает движение, является изотоническим сокращением. Изотонические сокращения необходимы для развития мышечной массы при поднятии тяжестей.
Мышечный тонус — это естественное состояние, при котором скелетная мышца всегда остается частично сокращенной.Мышечный тонус обеспечивает небольшое напряжение в мышцах, чтобы предотвратить повреждение мышц и суставов от резких движений, а также помогает поддерживать осанку тела. Все мышцы постоянно поддерживают определенный мышечный тонус, если только мышца не была отключена от центральной нервной системы из-за повреждения нервов.
Функциональные типы волокон скелетных мышц
Волокна скелетных мышц можно разделить на два типа в зависимости от того, как они производят и используют энергию: Тип I и Тип II.
- Волокна типа I сокращаются очень медленно и намеренно. Они очень устойчивы к усталости, потому что используют аэробное дыхание для производства энергии из сахара. Мы обнаруживаем волокна типа I в мышцах по всему телу, обеспечивающие выносливость и осанку. Около позвоночника и области шеи очень высокая концентрация волокон типа I поддерживает тело в течение дня.
Волокна типа II подразделяются на две подгруппы: тип II A и тип II B.
- Волокна типа II A быстрее и прочнее, чем волокна типа I, но не обладают такой высокой выносливостью.Волокна типа II A находятся по всему телу, но особенно в ногах, где они работают, чтобы поддерживать ваше тело в течение долгого дня ходьбы и стояния. Волокна
- типа II B даже быстрее и прочнее, чем волокна типа II A, но обладают еще меньшей выносливостью. Волокна типа II B также намного светлее, чем волокна типа I и типа II A, из-за отсутствия миоглобина, пигмента, накапливающего кислород. Мы находим волокна типа II B по всему телу, но особенно в верхней части тела, где они придают скорость и силу рукам и груди за счет выносливости.
Мышечный метаболизм и усталость
Мышцы получают энергию из разных источников в зависимости от ситуации, в которой они работают. Мышцы используют аэробное дыхание, когда мы призываем их произвести силу от низкого до умеренного. Аэробное дыхание требует кислорода для производства около 36-38 молекул АТФ из молекулы глюкозы. Аэробное дыхание очень эффективно и может продолжаться до тех пор, пока мышца получает достаточное количество кислорода и глюкозы для продолжения сокращения.Когда мы используем мышцы для создания высокого уровня силы, они становятся настолько плотными, что кислород, несущий кровь, не может попасть в мышцы. Это состояние заставляет мышцы вырабатывать энергию с помощью молочнокислого брожения, формы анаэробного дыхания. Анаэробное дыхание намного менее эффективно, чем аэробное дыхание — на каждую молекулу глюкозы вырабатывается только 2 АТФ. Мышцы быстро устают, поскольку они сжигают свои запасы энергии при анаэробном дыхании.
Чтобы мышцы работали дольше, мышечные волокна содержат несколько важных молекул энергии.Миоглобин, красный пигмент, обнаруживаемый в мышцах, содержит железо и хранит кислород так же, как гемоглобин в крови. Кислород миоглобина позволяет мышцам продолжать аэробное дыхание в отсутствие кислорода. Еще одно химическое вещество, которое помогает поддерживать работу мышц, — это креатинфосфат. Мышцы используют энергию в виде АТФ, превращая АТФ в АДФ, чтобы высвободить свою энергию. Креатинфосфат отдает свою фосфатную группу АДФ, чтобы превратить его обратно в АТФ, чтобы обеспечить мышцам дополнительную энергию.Наконец, мышечные волокна содержат гликоген, накапливающий энергию, большую макромолекулу, состоящую из множества связанных глюкоз. Активные мышцы расщепляют глюкозу из молекул гликогена, чтобы обеспечить внутреннее снабжение энергией.
Когда в мышцах заканчивается энергия во время аэробного или анаэробного дыхания, мышца быстро утомляется и теряет способность сокращаться. Это состояние известно как мышечная усталость. Утомленная мышца содержит очень мало или совсем не содержит кислорода, глюкозы или АТФ, но вместо этого имеет много продуктов жизнедеятельности дыхания, таких как молочная кислота и АДФ.Организм должен получать дополнительный кислород после нагрузки, чтобы заменить кислород, который был сохранен в миоглобине в мышечных волокнах, а также для обеспечения аэробного дыхания, которое восстановит запасы энергии внутри клетки. Кислородный долг (или восстановление потребления кислорода) — это название дополнительного кислорода, который организм должен потреблять, чтобы восстановить мышечные клетки до состояния покоя. Это объясняет, почему вы чувствуете одышку в течение нескольких минут после напряженной деятельности — ваше тело пытается вернуться в нормальное состояние.
Обзор мышечной системы — 5 фактов о мышцах
На простейшем уровне мышцы позволяют нам двигаться. Гладкая и сердечная мышца движутся, чтобы облегчить такие функции организма, как сердцебиение и пищеварение. Движение этих мышц направляется вегетативной частью нервной системы — это нервы, управляющие органами. Скелетные мышцы перемещают наши тела в пространстве. Они получают прямые инструкции от определенных нервов, которые иннервируют каждую мышцу.Хотите узнать больше о мышцах человеческого тела? Вот еще пять фактов о мышечной системе, которые следует помнить.
1. Более 600 скелетных мышц составляют около половины нашего веса
Мышцы, приводящие в движение человеческий скелет, сильно различаются по форме и размеру и охватывают все части нашего тела. Только в мышечной системе содержится более 600 скелетных мышц, которые составляют около 40% нашей массы. Кровеносные сосуды и нервы проходят к каждой мышце, помогая контролировать и регулировать функцию каждой мышцы.
2. Скелетные мышцы прикрепляются к костям
В мышечной системе скелетные мышцы соединены со скелетом либо с костью, либо с соединительными тканями, такими как связки. Мышцы всегда прикрепляются в двух или более местах. Когда мышца сокращается, точки прикрепления сближаются; когда он расслабляется, точки крепления раздвигаются.
3. Мышцы, тянущие к костям, чтобы двигать телом
Мышцы сокращаются и расслабляются для движения костей. Локтевой сустав сгибается (сгибается), когда мышцы тянут на лучевую и локтевую кость руки.Мышцы сокращаются, когда сообщения передаются от нервов к мышцам и запускают химические реакции. Эти реакции изменяют внутреннюю структуру клеток мышечных волокон, в результате чего мышца укорачивается. Мышечные волокна расслабляются, когда сигнал нервной системы больше не присутствует, тем самым обращая сокращение.
4. Мышцы составляют стенки многих органов
Не вся мышечная ткань — это скелетная мышца. Гладкая мышечная ткань находится в стенках многих органов человеческого тела и помогает этим органам двигаться, облегчая функции организма.Пищеварительный канал (пищевод, желудок и кишечник) включает мышечную ткань, которая сокращается и расслабляется для перемещения питательных веществ в процессе пищеварения. Мочевой пузырь также включает мышечную ткань, которая сокращается и расслабляется, удерживая и выделяя мочу. Сердцебиение — это результат сокращения и расслабления мышечной ткани сердечной стенки. Гладкие мышцы стенок артерий помогают перемещать кровь по телу.
5. Соматические двигательные сигналы перемещают скелетные мышцы
Как двигаются скелетные мышцы? Это происходит, когда мышечная система и нервная система работают вместе: соматические сигналы отправляются из коры головного мозга к нервам, связанным с определенными скелетными мышцами.Большинство сигналов проходит через спинномозговые нервы, которые соединяются с нервами, которые иннервируют скелетные мышцы по всему телу. Хотите согнуть локтевой сустав? Кора головного мозга посылает сигнал через спинной нерв к нервам, которые иннервируют мышцы вокруг локтевого сустава. Когда этот сигнал достигает мышечной ткани, ее клетки реорганизуются, вызывая сокращение, которое сгибает локтевой сустав!
границ | Внеклеточный матрикс скелетных мышц — что мы знаем о его составе, регуляции и физиологической роли? Повествовательный обзор
Введение
Скелетные мышцы являются важным компонентом состава тела человека, обычно составляя более 40% и 30% общей массы тела у мужчин и женщин, соответственно (Kim et al., 2002). Наиболее очевидная функция скелетных мышц — генерировать силы, необходимые для поддержания вертикальной позы и движения. Однако скелетные мышцы также играют важную роль во многих других физиологических процессах, включая термогенез (Rowland et al., 2015), метаболизм (Baskin et al., 2015) и секрецию многочисленных пептидов для связи с другими тканями (Pedersen and Febbraio , 2012). Таким образом, укрепление и поддержание здоровья скелетных мышц имеет жизненно важное значение.Хотя в последние годы фармакологические имитаторы упражнений вызывают все больший научный интерес (Fan and Evans, 2017), именно физические упражнения по-прежнему считаются наиболее мощным и универсально применимым инструментом для этих целей.
За последние десятилетия были выполнены тысячи тренировочных исследований в попытке определить методы упражнений, наиболее подходящие для увеличения размера мышц и улучшения их функциональных характеристик в различных когортах (например, на момент написания этой рукописи Pubmed дал больше более 24 000 результатов по операторам поиска «упражнения» и «сила мышц»).Результаты этих исследований послужили источником вдохновения для различных руководств по назначению упражнений, вероятно, наиболее известными из которых являются стенды с позициями, публикуемые и обновляемые через нерегулярные промежутки времени Американским колледжем спортивной медицины (2009), Garber et al. (2011). Большинство исследований основывают свою оценку эффективности тренировочных вмешательств на исследовании сократительных мышечных клеток. Часто изучаемые параметры включают размер мышц, измеренный на уровне органа (Fisher et al., 2011) или на клеточном уровне (Schoenfeld, 2010), распределение типов волокон (Adams et al., 1993), архитектуру (Aagaard et al., 2001), а также нервный импульс к мышцам (Folland and Williams, 2007).
Несмотря на обилие информации о пластичности скелетных мышц, часто упускается из виду тот факт, что мышечные волокна встроены во внеклеточный матрикс (ECM), состоящий из сетки коллагеновых компонентов, а также смеси других макромолекул, таких как различные гликопротеины и протеогликаны. Недавние исследования показали, что ECM играет важную роль в развитии (Thorsteinsdóttir et al., 2011), рост (Fry et al., 2017) и восстановление мышц (Calve et al., 2010), а также передача сократительной силы (Street, 1983). Несмотря на то, что доказательства, демонстрирующие податливость ЕСМ, существуют, лишь в небольшом количестве исследований сообщается о его реакциях на различные формы тренировок, что позволяет предположить, что физиологическая роль ЕСМ еще не полностью оценена специалистами по физическим упражнениям. Стремясь стимулировать дальнейшие исследования тренировочных реакций неконтрактильных компонентов скелетных мышц, мы предлагаем обзор текущего состояния знаний о составе, структуре и регуляции внеклеточного матрикса, его физиологической роли, нарушениях регуляции, связанных со старением и метаболизмом. расстройства, а также адаптации к физическим нагрузкам.
Состав и структура ECM скелетных мышц
ECM скелетных мышц представляет собой сложную сеть, состоящую из коллагенов, гликопротеинов, протеогликанов и эластина (Takala and Virtanen, 2000; Halper and Kjaer, 2014). Коллагены образуют сеть внутримышечной соединительной ткани (IMCT), то есть центральные фиброзные компоненты ECM. IMCT обычно изображается организованной в виде трех слоев: (i) эндомизий, представляющий самый внутренний слой, который охватывает отдельные мышечные волокна, (ii) группы мышечных волокон, связывающие перимизий, и (iii) эпимизий, охватывающий всю мышцу.Большая структурная сложность сети ММКИ, подтвержденная сканирующими электронными микрофотографиями, предполагает, что эта традиционная классификация может быть упрощенной и что организация ECM мышц более высокого порядка еще нуждается в определении (Gillies and Lieber, 2011). При исследовании фасциальных тканей слои IMCT рассматриваются как часть сложной системы взаимосвязанных и переплетенных соединительных тканей, которые «окружают, переплетаются между собой и проникают во все органы, мышцы, кости и нервные волокна, обеспечивая тело функциональной структурой. и обеспечение среды, которая позволяет всем системам организма работать интегрированно » (Adstrum et al., 2017; Stecco et al., 2018). Эта система, которую обычно называют фасциальной системой, все чаще признается важной мишенью в спортивной медицине (Zügel et al., 2018).
IMCT содержит различные формы коллагенов, среди которых наиболее распространены типы I и III (Duance et al., 1977; Light and Champion, 1984; Gillies and Lieber, 2011; McKee et al., 2019). Эндомизий взаимодействует с сарколеммой миофибр через специализированную базальную мембрану, которая состоит в основном из коллагена IV типа и ламинина (Sanes, 1982; Martin and Timpl, 1987; Kjaer, 2004).Было обнаружено, что концентрация этих двух компонентов различается в зависимости от типа мышечного волокна, при этом медленно сокращающиеся волокна характеризуются значительно большей концентрацией коллагена IV, но более низкой концентрацией ламинина (Kovanen et al., 1988). Ламинин, в свою очередь, служит лигандом для двух сарколеммальных рецепторов — гликопротеинового комплекса, ассоциированного с дистрофином, и интегрина α7β1 (Grounds et al., 2005) — расположенных на костамерах, которые представляют собой мембранные белковые структуры, выровненные в соответствии с Z- диски миофибрилл.Считается, что интегрины действуют двунаправленно, позволяя внутриклеточным сигнальным молекулам регулировать внешнюю адгезию (передача сигналов «Inside-Out») и передавать внешние стимулы для воздействия на клеточные процессы (передача сигналов «Outside-In») (Boppart and Mahmassani, 2019) . Таким образом, явный стресс цитоскелета индуцирует внутриклеточное связывание белков, таких как талин, винкулин или киндлин, что приводит к изменению конформации рецептора интегрина и позволяет внеклеточным доменам рецептора распространяться в направлении белков внутри ЕСМ.Кроме того, лиганды интегринов из внеклеточного пространства, такие как ламинин, коллаген или фибронектин, способствуют формированию высокоаффинного вертикального состояния, что приводит к усилению связывания с белками ЕСМ и кластеризации интегринов, особенно вдоль комплексов фокальной адгезии (Boppart and Mahmassani, 2019) . Гликопротеиновый комплекс, связанный с дистрофином, является еще одним важным фактором в обеспечении механической связи между сократительными компонентами скелетных мышц (т.е.актином) и взаимосвязанными слоями IMCT (Ervasti, 1993; Peter et al., 2011). Основные компоненты, связывающие сократительные элементы мышцы с интерстициальным матриксом, показаны на рисунке 1.
Рисунок 1. Основные компоненты внеклеточного матрикса скелетных мышц и его связь с сократительными компонентами мышцы.
Суперсемейство коллагена состоит в общей сложности из 28 различных членов, из которых типы I, III, IV, V, VI, XII, XIII, XIV, XV, XVIII и XXII, как было показано, присутствуют в зрелых скелетных мышцах в гене и / или уровень белка (Таблица 1).Формирующие фибриллы типы I и III, безусловно, наиболее многочисленны, и протеомные исследования показывают, что они вместе составляют примерно 75% от общего мышечного коллагена (McKee et al., 2019). Предполагается, что прочные параллельные волокна коллагена I типа, присутствующие в эндо-, пери- и эпимизиуме, придают мышцам прочность на разрыв и жесткость, тогда как коллаген III типа образует рыхлую сеть волокон, которая придает эластичность мышцам. эндо- и перимизий (Кованен, 2002). Коллаген типа IV, спиральная молекула, образует сетчатую структуру, которая составляет основу базальной пластинки (Sanes, 2003).Коллаген типа VI был обнаружен в эпимизиальном, перимизиальном и эндомизиальном интерстиции, но, в частности, в окрестностях базальной мембраны, где он взаимодействует с карбоксиконцевым глобулярным доменом коллагена типа IV (Kuo et al., 1997). Интересно, что коллаген VI обладает нетипичными неколлагеновыми участками, формирующими отчетливую микрофибриллярную сеть в большинстве соединительных тканей (Maaß et al., 2016). Мутации коллагена VI приводят к заболеваниям с сочетанным вовлечением мышц и соединительной ткани, включая врожденную мышечную дистрофию Ульриха, миопатию Бетлема, аутосомно-доминантную мышечную дистрофию пояса конечностей и аутосомно-рецессивный миосклероз (Bushby et al., 2014).
Таблица 1. Обзор коллагеновых компонентов внеклеточного матрикса скелетных мышц.
Коллаген типов XII, XIV, XIX и XXII принадлежит к ассоциированным с фибриллами коллагенам с прерывистыми тройными спиралями (FACIT; Chiquet et al., 2014; Calvo et al., 2020), при этом коллаген типа XXII, по-видимому, экспрессируется исключительно в тканях. соединения, такие как мышечно-сухожильные соединения в скелетных и сердечных мышцах (Koch et al., 2004).
Биоинформатические инструменты для скрининга протеома человека нормальных и больных тканей позволили охарактеризовать глобальный состав протеома ЕСМ, или «матрисомы.В общей сложности 1027 генов были связаны с ЕСМ, посредством чего основные белки матрисомы (гликопротеины ЕСМ, коллагены и протеогликаны) можно было отличить от белков, связанных с матрисомами (аффилированные с ЕСМ белки, регуляторы ЕСМ и секретируемые факторы, которые могут взаимодействовать с core ECM белки) (Naba et al., 2016). Учитывая сложность ткани скелетных мышц человека, включающей многоядерные мышечные волокна, иммунные клетки, эндотелиальные клетки, мышечные стволовые клетки, немиогенные мезенхимальные предшественники и другие мононуклеарные клетки (Bentzinger et al., 2013a), будущие исследования будут необходимы для выяснения вклада каждой из этих клеток в структуру и реконструкцию IMCT. Сигнатуры генов, полученные, например, из последовательности РНК изолированных мышечных волокон и других типов клеток, представляют собой многообещающий инструмент для деконволюции основной массы скелетной мышечной ткани (Rubenstein et al., 2020).
Физиологическая регуляция генов ЕСМ
Гомеостаз ЕСМ поддерживается посредством точно настроенных анаболических и катаболических процессов, которые регулируются различными факторами роста, протеогликанами и ферментами, ответственными за деградацию коллагена.Было обнаружено, что после связывания с мембранно-связанными рецепторами факторы роста, принадлежащие к суперсемейству трансформирующих факторов роста бета (TGF-β), индуцируют фосфорилирование белков Smad, которые передают внеклеточные сигналы в ядро, где они активируют транскрипцию нижележащих генов, что приводит к продукции коллагена. (Макдональд и Кон, 2012). Другим, хотя и менее описанным, фактором аналогичной функции является фактор роста соединительной ткани (CTGF), избыточная экспрессия которого, как сообщается, провоцирует дистрофический фиброз мышц и функциональные нарушения (Morales et al., 2011).
Функция этих анаболических факторов в основном регулируется небольшими протеогликанами, богатыми лейцином (SLRP). Декорин, прототип этого семейства, деактивирует профибротический TGF-β и CTGF (Zhu et al., 2007; Brandan and Gutierrez, 2013), а также ограничивает фибриллогенез путем прямого связывания с коллагеном I типа (Reese et al., 2013) . Другой SLRP представлен бигликаном, который конкурирует с декорином за тот же сайт связывания на коллагене (Schönherr et al., 1995) и, вероятно, играет роль как в формировании, так и в регенерации мышц (Brandan et al., 2008).
Транскрипционная регуляция образования белков, по-видимому, является важным фактором пластичности ECM. В этом отношении было показано, что экспрессия белка в скелетных мышцах слабо регулируется на уровне мРНК, что приводит к большим различиям в содержании мРНК и белка в различных тканях (Wang et al., 2019). Интересно, что характер регуляции белка зависит от функции белка, при этом ассоциация между мРНК и белком выше для ECM и организации коллагеновых фибрилл (Makhnovskii et al., 2020). Другим интересным аспектом регуляции количества белков ЕСМ является тот факт, что индукция транскрипции для коллагена, по-видимому, довольно медленная, поскольку для полной индукции транскрипции требуется почти 3 дня. Напротив, скорость секреции адаптируется быстро, поскольку она повышается менее чем за 1 час. В клетках с высоким уровнем продуцирования коллагена этот путь контролируется посттранскрипционной регуляцией, которая требует контроля с обратной связью между скоростью секреции и трансляции (обзор у Schwarz, 2015).
Что касается ремоделирования ткани, два семейства ферментов, матриксные металлопротеиназы (MMP) и тканевые ингибиторы металлопротеиназ (TIMP), участвуют в регуляции гомеостаза ECM. ММП представляют собой протеолитические ферменты, которые разрушают различные типы коллагенов и ингибируются ТИМП (Visse and Nagase, 2003; Alameddine, 2012). В частности, MMP-1 и MMP-8 инициируют деградацию коллагенов I и III (преобладающих в эндо-, пери- и эпимизиуме), тогда как MMP-2 и MMP-9 расщепляют коллаген IV типа (основной коллагеновый компонент базальная мембрана) (Corcoran et al., 1996). ТИМП-1, -2 и -4 способны ингибировать все известные ММП (Christensen and Purslow, 2016).
ECM и сила скелетных мышц
Взаимодействие актина и миозина, а также многих других саркомерных белков приводит к укорочению мышечных волокон. Традиционные биомеханические модели часто изображают мышечно-сухожильные единицы как системы, в которых силы, возникающие в результате укорочения волокна, передаются продольно вдоль мышечного волокна и далее в мышечно-сухожильном соединении на сухожилие.Рядом с мышечно-сухожильным соединением миофибриллы имеют отростки, похожие на пальцы, которые образованы из инвагинаций плазматической мембраны (Knudsen et al., 2015). Эта структура увеличивает площадь поверхности, доступную для передачи усилия. Ожидается, что передача силы будет происходить между пальцевидными отростками мышечного волокна и коллагеновыми волокнами, расположенными внутри инвагинаций, посредством срезания базальной пластинки (Huijing, 1999). Содержащиеся здесь коллагены относятся к типу XXII, который образует внутренний слой, а также к III, VI, XII и XIV, которые расположены дальше от мембраны мышечных волокон (Jakobsen et al., 2017). Хотя его точная роль до сих пор неясна, интересно отметить, что в мышцах коллаген XXII располагается исключительно в мышечно-сухожильном соединении. У рыб-зебр дефицит коллагена XXII, как было обнаружено, приводит к мышечной дистрофии (Charvet et al., 2013), предполагая, что этот коллаген может служить для поддержания структурной целостности и стабилизации мышечно-сухожильного соединения.
Учитывая тот факт, что значительная часть волокон в длинных мышцах оканчивается внутрипучкообразно, не достигая непосредственно сухожилия (Barrett, 1962; Hijikata et al., 1993), однако ясно, что мышечно-сухожильный путь не может быть единственным механизмом передачи силы. Внутрисосудистые концевые волокна должны опираться на среду, расположенную параллельно им, чтобы передавать свои силы на пассивные компоненты опорно-двигательной системы (Sheard, 2000). Как впервые было обнаружено Стрит (1983), именно сеть ММКИ внутри ВЦМ способствует такой боковой передаче сократительной силы. Передача силы через сеть IMCT происходит от сократительных белков через костамеры к эндомизию (Bloch and Gonzalez-Serratos, 2003; Peter et al., 2011) — как показывают исследования моделирования, через срезание (Sharafi and Blemker, 2011; Zhang and Gao, 2012) — и далее в перимизий, который окончательно сливается с апоневрозами и сухожилиями (Passerieux et al., 2007). Первые сведения о пропорциях передачи продольной и поперечной силы в поперечнополосатых мышцах получены из элегантных экспериментов Huijing et al. (1998). После разрыва прямых соединений нескольких головок длинного разгибателя пальцев рук крысы, соответствующих 55% общей мышечной массы, от суставного сухожилия, Huijing et al.(1998) наблюдали, что сила поддерживалась на уровне 84% от силы неповрежденной мышцы. Совсем недавно Ramaswamy et al. (2011) использовали коромысло для прямого измерения сил, передаваемых по продольным и поперечным путям. Их результаты не только подтвердили, что более 50% силы передавалось латерально, но также показали, что латеральная передача силы была значительно снижена как у дистрофических, так и у старых грызунов. Позже их результаты были подтверждены Чжаном и Гао (2014).
Некоторые аргументы предполагают, что боковая передача силы является биомеханической необходимостью для поддержания целостности мышц и повышения эффективности сокращения.Во-первых, он помогает распределять сократительные силы по всей поверхности миофибрилл, что снижает механическое напряжение и защищает волокна от чрезмерного растяжения. Это может быть особенно важно в концевых областях волокон, которые обычно имеют конус и поэтому не подходят для выдерживания чрезмерных усилий (Monti et al., 1999). Косвенным подтверждением этой гипотезы являются исследования с участием пожилых людей (Hughes et al., 2016) или пациентов, страдающих дистрофией Дюшенна (Virgilio et al., 2015), у которых дистрофин (i.е. костамерный белок, который устанавливает механическую связь между цитоскелетом, сарколеммой и ECM и, таким образом, облегчает передачу латеральной силы) либо теряется, либо нарушается, и восприимчивость к травмам от растяжения мышц увеличивается.
Кроме того, считается, что передача латеральной силы приводит к сокращению волокон моста либо в разное время, либо в разной степени (Yucesoy et al., 2006), что помогает поддерживать выравнивание волокон и, таким образом, структурную целостность мышцы (Purslow, 2002).Недавно Dieterich et al. (2017) сравнили начало сокращения, определенное электромиографией и УЗИ в M-режиме. Как ни странно, авторы обнаружили, что начало движения предшествует электромиографическому сигналу в ~ 20% исследований, что можно объяснить переносом латеральной силы. Действительно, в то время как продольная передача сил может быть задержана из-за необходимости натянуть эластичные элементы, размещенные последовательно с мышцей (Nordez et al., 2009), трансламинарное сцепление сдвига между мышечными волокнами и сетью IMCT может обеспечить немедленную передачу силы. .Наконец, передача боковой силы обеспечивает механизм, посредством которого сила может по-прежнему генерироваться и передаваться от мышечных волокон, которые прерваны из-за микротравм или во время роста мышц (Purslow, 2010).
Помимо своей роли в латеральной передаче сократительной силы, ECM может также влиять на укорочение мышечных волокон. Часто предполагается, что сократимость миофибрилл ограничивается геометрией составляющих его саркомеров: саркомера и, таким образом, укорочение волокна прекращается, когда полосы z входят в контакт с миозиновыми нитями.Однако эти идеи рассматривают только поведение саркомера как независимого исполнительного механизма. В условиях in vivo мышечные волокна встраиваются в сеть IMCT, что может препятствовать укорочению волокон. Действительно, принцип постоянного объема (Baskin and Paolini, 1967) диктует, что во время укорачивания мышечные волокна должны подвергаться радиальному расширению, что уже давно экспериментально подтверждено даже на саркомерном уровне (Brandt et al., 1967). Новые вычислительные модели и измерений in situ в мышцах лягушки Азизи и др.(2017) продемонстрировали, что сокращение мышц затруднено, когда радиальное расширение ограничено физическими ограничениями. Следовательно, изменения количества и механических свойств сети IMCT, в которую встроены мышечные волокна, могут напрямую влиять на сократимость скелетных мышц. Такой сценарий может быть представлен мышечным фиброзом (Gillies et al., 2017).
ECM в развитии, росте и восстановлении скелетных мышц
Помимо передачи силы, ECM скелетных мышц выполняет несколько важных функциональных ролей.Очевидно, сеть ММКИ обеспечивает механическую поддержку мышечным волокнам, а также поддерживающим их нервам и кровеносным сосудам. Кровеносные капилляры проходят в промежутках, занятых эндомизием, их количество и плотность зависят от размера мышечных волокон (Janácek et al., 2009). Помимо этой наиболее очевидной роли, взаимодействие между миобластами, дифференцированными мышечными волокнами и компонентами внеклеточного матрикса имеет центральное значение для эмбриогенного развития, дальнейшего роста и восстановления мышечной ткани.
Клеточным источником коллагеновых компонентов мышечного ECM являются специальные фибробласты IMCT, которые происходят из различных эмбриогенных источников, включая сомиты (Nowicki et al., 2003), мезодерму латеральной пластинки (Pearse et al., 2007) и нервную систему. клетки гребня (Olsson et al., 2001). Поскольку они продуцируют не только фибробласты, но и адипогенные клетки, фибробласты IMCT могут рассматриваться как фиброипогенные предшественники (Uezumi et al., 2010). Недавние исследования предоставили доказательства того, что, помимо этих очевидных ролей, фибробласты IMCT и производимые ими соединительные ткани влияют на миогенез (т.е.д., образование мышечных предшественников и их дифференциация в многоядерные миофибриллы) и морфогенез мышц (то есть процесс, в котором миофибры собираются в мышцы), таким образом действуя как важные регуляторы развития мышц. Эти сложные регуляторные процессы, происходящие во время эмбриогенного развития, здесь подробно не рассматриваются, но были подробно рассмотрены в других источниках (Nassari et al., 2017; Sefton and Kardon, 2019). Вкратце, IMCT направляет мышечных предшественников к их назначенным областям-мишеням посредством комбинации привлекательных (фактор роста гепатоцитов, фактор, производный стромальными клетками) и отталкивающих сигналов (эфрин) (Dietrich et al., 1999; Swartz et al., 2001). Посредством множества факторов транскрипции, экспрессируемых в фибробластах IMCT, IMCT затем способствует пролиферации, выживанию и дифференцировке соседних миобластов в зрелые миофибриллы (Kardon et al., 2003; Hasson et al., 2010; Iwata et al., 2013; Vallecillo -García et al., 2017). Таким образом, можно предположить, что IMCT служит мезодермальным препаттерном, который контролирует участки дифференцировки миофибрилл и, следовательно, окончательное положение, размер и форму мышц.
Как постмитотические ткани, скелетные мышцы зависят от сателлитных клеток для адаптации и регенерации на протяжении всей жизни. Эти стволовые клетки располагаются в специализированных нишах между сарколеммой мышечных волокон и их инкапсулирующими базальными мембранами. Поддержание, активация и дифференцировка сателлитных клеток регулируются сложными каскадами факторов транскрипции. Для подробного обзора этих сотовых схем читатели могут обратиться к недавнему обзору Almada and Wagers (2016). Имея особое отношение к этой рукописи, растущее количество доказательств указывает на то, что на судьбу сателлитных клеток также сильно влияют взаимодействия с нишей ECM, в которой они находятся.Действительно, как динамическая среда ниша стволовых клеток передает механические и химические сигналы, которые действуют, защищая покоящиеся стволовые клетки или индуцируя активацию, пролиферацию и дифференцировку.
В состоянии покоя сателлитные клетки экспрессируют канонический клеточный регулятор спаренный бокс-белок 7 (PAX7) (Olguin and Olwin, 2004). Исследования in vitro показали, что большая часть сателлитных клеток экспрессирует PAX7 при культивировании на матригеле, смеси белков ЕСМ и факторов роста (Wilschut et al., 2010; Грефте и др., 2012). Дальнейшее подтверждение идеи, что ECM активно участвует в поддержании покоя сателлитных клеток, происходит из сообщений о том, что сателлитные клетки, удаленные из своей ниши, быстро входят в клеточный цикл и теряют свою способность к миогенной дифференцировке (Gilbert et al., 2010). Интересно, что сателлитные клетки, по-видимому, также способны воспринимать различные механические свойства ECM и реагировать на них. Фактически, экспрессия PAX7 и выживаемость сателлитных клеток выше при культивировании на гидрогелях, имитирующих физиологическую жесткость мышц (Gilbert et al., 2010). Кроме того, сателлитные клетки, культивируемые на мягком гидрогеле, обладают большей функциональной способностью после трансплантации в мышцу реципиента (Cosgrove et al., 2014).
Кроме того, было показано, что компоненты ECM влияют на деление стволовых клеток. В частности, белки фибронектин (Bentzinger et al., 2013b) и коллаген VI (Urciuolo et al., 2013), а также протеогликаны синдекан 3, синдекан 4, перлекан и декорин (Cornelison et al., 2001; Brack et al. ., 2008) были идентифицированы как составляющие ниши, влияющие на баланс между дифференцировкой и самообновлением и, таким образом, на поддержание регенеративной способности скелетных мышц.
При мышечной травме или в ответ на повышенную нагрузку обычно в основном покоящиеся сателлитные клетки активируются и дифференцируются в миобласты, чтобы окончательно слиться в зрелые миофибриллы. Хотя этот процесс требует своевременной экспрессии различных факторов транскрипции, таких как миогенный фактор 5, белок миогенной детерминации или миогенин (Almada and Wagers, 2016), несколько исследований указывают на влияние ECM на каждый из этих этапов. Эксперименты с миобластами мышей (Grefte et al., 2012) или свиней (Wilschut et al., 2010) показали, что на слияние миобластов положительно влияет матригель, но не отдельные субстраты, присутствующие в нише ECM. Вклад отдельных белков все еще плохо изучен, однако одновременное присутствие поли- D -лизина и ламинина (Boonen et al., 2009), гликозаминогликанов (Rønning et al., 2013) и протеогликанов сульфата гепарина (Gutiérrez и Brandan, 2010), по-видимому, играют важную роль в пролиферации и дифференцировке сателлитных клеток. После активации стволовых клеток скелетных мышц локальное ремоделирование ВКМ сопровождается отложением ламинина-α1 и ламинина-α5 в базальной пластинке ниши сателлитных клеток (Rayagiri et al., 2018). На мышах было показано, что мышечные сателлитные клетки продуцируют коллагены ЕСМ для поддержания покоя клеточно-автономным образом, при этом коллаген V является критическим компонентом покоящейся ниши, поскольку истощение приводит к аномальному вхождению в клеточный цикл и постепенному уменьшению стволовых клеток. бассейн (Багдади и др., 2018). Так же, как для поддержания покоя, адекватные механические свойства ниши ECM также могут быть важны для созревания сателлитных клеток. Действительно, было обнаружено, что миотрубки оптимально дифференцируются на субстратах с мышечной жесткостью (Engler et al., 2004). В совокупности эти данные предполагают, что усиление жесткости ВКМ, сопровождающее как различные скелетно-мышечные нарушения, так и процесс старения, может отрицательно влиять на регенеративную способность мышцы.
Ремоделирование мышц ECM со старением
В более старшем возрасте скелетные мышцы обычно демонстрируют фиброзную морфологию (Lieber and Ward, 2013). В отличие от фасциального уплотнения, при котором может сохраняться общая структура коллагенов (Pavan et al., 2014), возрастной мышечный фиброз характеризуется потерей четкой двунаправленной ориентации решетки здоровых перимизиальных волокон коллагена и его замещением. из-за неустойчивой оптоволоконной сети со сниженным образованием складок (Ярвинен и др., 2002). Кроме того, может увеличиваться абсолютное содержание коллагена и (неферментативное) сшивание коллагеновых волокон (Haus et al., 2007b). Таким образом, модуль упругости ЕСМ может быть увеличен примерно в 35 раз (с ~ 12 кПа в молодых до ~ 418 кПа в старых мышцах; Yin et al., 2013), причем этот эффект обусловлен накоплением плотно упакованных и сильно сшитый коллаген (Wood et al., 2014). У крупных и долгоживущих животных, таких как тюлени Уэдделла, наблюдалось увеличение внеклеточного пространства на 35-40% по мере увеличения общего и относительного содержания коллагена с возрастом.Однако это увеличение связано со сдвигом в сторону более высокого отношения коллагена типа I к коллагену типа III (Hindle et al., 2009). Более того, концентрация коллагена IV типа повышается в базальной пластинке медленно сокращающихся мышц, тогда как концентрация ламинина, по-видимому, снижается с возрастом (Kovanen et al., 1988). Было также показано, что повышенное отложение белков базальной пластинки вытесняет сателлитные клетки из их ниш, что влияет на регуляцию делений сателлитных клеток (Snow, 1977) и может объяснять меньшее количество сателлитных клеток, обычно учитываемых в старых мышцах по сравнению с молодыми мышцами. (Брак и др., 2007). Утрата и функциональная инактивация стволовых клеток, которые негативно влияют на гомеостаз тканей, могут рассматриваться как общий признак старения (López-Otín et al., 2013), который следует рассматривать как универсальную силу, приводящую к старению мышц (Brack and Muñoz-Cánoves, 2016) и другие ткани (Oh et al., 2014). Помимо воздействия на сателлитные клетки, нерегулируемая базальная пластинка также, как ожидается, нарушит регенеративную способность мышц из-за неадекватной поддержки мышечных волокон и дезорганизованной ориентации каркаса (Sanes, 2003).Обзор, включающий обширный обзор эффектов старения на ECM скелетных мышц, был недавно опубликован Etienne et al. (2020).
Интересно, что данные транскрипционного профилирования мышц молодых и старых крыс предполагают, что из 682 наборов зондов, которые значительно различались между молодыми и старыми животными, 347 генов фактически уменьшились (а не увеличились) в старых / саркопенических мышцах по сравнению с молодыми мышцами. Было показано, что из этих генов 24% играют биологическую роль в ECM и клеточной адгезии (Pattison et al., 2003). Эти данные подтверждают гипотезу, что возрастные изменения в ECM могут быть вызваны сниженной способностью к деградации, а не повышенным синтезом коллагеновых структур. В частности, ММП, по-видимому, играют важную роль в этих процессах (de Sousa Neto et al., 2018). Это также подтверждается результатами, которые предполагают снижение способности структур ВКМ к ремоделированию структур ВКМ в старых мышцах, вызванное упражнениями с отягощением (Wessner et al., 2019). Хотя механизмы еще полностью не изучены, также считается, что эти изменения напрямую ухудшают функцию мышц, препятствуя сократимости волокон (Azizi et al., 2017) и передача поперечной силы (Sharafi and Blemker, 2011).
Нарушение регуляции ECM скелетных мышц вследствие метаболических нарушений
Хорошо известно, что скелетные мышцы играют важную роль в стимулированном инсулином поглощении глюкозы (Richter and Hargreaves, 2013). Роль ECM в этом контексте может быть менее ясной. Мышцы-специфичные интегрин-β1-дефицитные мыши демонстрируют снижение скорости инфузии глюкозы, стимулированной инсулином, и клиренса глюкозы, несмотря на отсутствие изменений в приеме пищи, весе, глюкозе натощак, уровнях инсулина и экспрессии белка GLUT4 (Zong et al., 2009), подтверждая связь между аберрантной передачей сигналов интегрина и развитием диабета 2 типа. Более того, на животной модели диабета было показано, что нарушение чувствительности к инсулину связано со снижением уровней белка изоформы дистрофина Dp427 и субкомплекса альфа / бета-дистрогликана (Mulvey et al., 2005).
Повышенное количество коллагена типа I и III было обнаружено как у пациентов с диабетом 2 типа, так и у недиабетиков с ожирением (Berria et al., 2006), а перекорм у людей был связан с увеличением экспрессии генов, связанных с IMCT (коллагены I, III, IV, V, SPARC, интегрин; Tam et al., 2014) и изменения в генных путях, связанных с взаимодействием рецепторов ECM, фокальной адгезией и сращиванием (Tam et al., 2017). Однако кормление мышей диетой с высоким содержанием жиров привело к снижению уровней экспрессии генов COL1, COL3 и COL6, но не уровня белка (Tam et al., 2015).
Деградация коллагенов посредством MMPs, как было показано, является важным компонентом ремоделирования ECM (Cui et al., 2017). Может ли это быть правдой и в контексте диабета, было исследовано в исследовании на животных.Интересно, что генетическое истощение MMP9 не вызывало инсулинорезистентности у худых мышей, несмотря на то, что приводило к увеличению коллагена IV. Однако, когда мышей кормили диетой с высоким содержанием жиров, делеция вызывала глубокое состояние инсулинорезистентности. Эти результаты еще больше усиливают роль компонентов ММКИ в развитии мышечной инсулинорезистентности, особенно в состоянии переедания (Kang et al., 2014).
Наконец, гиалуронан, основной компонент внеклеточного матрикса, увеличивается при ожирении у мышей, вызванном диетой с высоким содержанием жиров.Для лечения инсулинорезистентности с сопутствующим уменьшением жировой массы, размера адипоцитов, а также печеночной и мышечной инсулинорезистентности (Kang et al., 2013) предлагается лечение с помощью PEGPh30, который дозозависимо снижает гиалуронан в мышечном ECM.
Подводя итог, можно сказать, что различные компоненты ECM подвержены влиянию на различных стадиях диабета. Исследования о том, связан ли диабет со слабостью мышц, противоречивы (Leong et al., 2015; Li et al., 2016), и еще предстоит выяснить, имеют ли непосредственное отношение к этому контексту изменения в проводящих путях, связанных с ECM.
Адаптация к физическому воспитанию и неиспользование
Первые свидетельства, указывающие на гибкость ММКИ в ответ на физическую активность, были опубликованы еще в 1970-х годах, когда Suominen и Heikkinen (1975) и Suominen et al. (1977) обнаружили более высокие уровни пролилгидроксилазы (фермента, способствующего биосинтезу коллагена) у тренированных на выносливость спортсменов, а также в продольном исследовании после восьми недель аэробных тренировок. Позже было обнаружено, что влияние упражнений на выносливость на активность проколлагеновых ферментов более выражено в красных мышцах по сравнению с белыми мышцами (Takala et al., 1983). Прямые измерения содержания коллагена, впервые проведенные в конце 1980-х годов, подтвердили, что содержание коллагена (типа IV) увеличилось в устойчивой к усталости камбаловидной мышце крыс после пожизненных тренировок на выносливость (Kovanen et al., 1988). Несмотря на вызванное физическими упражнениями увеличение коллагена, Gosselin et al. (1998) обнаружили, что жесткости мышц, наблюдаемой с возрастом, можно противодействовать с помощью упражнений на выносливость, которые авторы связывают с уменьшением сшивания гидроксилизилпиридинолином коллагеновых волокон.
Эффекты иммобилизации на ECM скелетных мышц не совсем однозначны. Ранние исследования Karpakka et al. (1990, 1991) обнаружили, что у крыс снижается как активность гидроксилазы, так и содержание гидроксипролина (аминокислоты, составляющей коллагены). Позже было обнаружено, что изменения содержания коллагена в ответ на кратковременную иммобилизацию или неиспользование были довольно небольшими (Savolainen et al., 1988; Haus et al., 2007a), что можно объяснить относительно низкой скоростью обновления. В более позднем исследовании, напротив, было обнаружено, что содержание коллагена I и биомеханические свойства (модуль упругости, максимальное напряжение и предел текучести) фасции голени, покрывающей трехглавую мышцу surae крысы, значительно увеличиваются после всего лишь 21 дня разгрузки задней конечности. (Хуанг и др., 2018). Интересно, что эти изменения можно предотвратить, применяя вибрацию к задним лапам крыс дважды в день. У людей, не занимающихся спортом, иммуногистохимическое окрашивание не показало изменений в плотности сети коллагена I после 60 дней постельного режима. Напротив, у субъектов, выполняющих протокол контрмер, состоящий из реактивных прыжков на санях, иммунореактивность коллагена I была снижена по сравнению с исходными уровнями (Schoenrock et al., 2018).
Еще одна модель, которая позволяет изучить адаптивность ECM мышц, — это функциональная перегрузка, вызванная устранением хирургического синергиста.В одном из первых соответствующих исследований Уильямс и Голдспинк (1981) перерезали сухожилия подошвенных и икроножных мышц самцов крыс, чтобы перегрузить камбаловидные мышцы. Гипертрофия мышц, наблюдаемая через три недели после тенотомии, сопровождалась увеличением концентрации IMCT (> 45%) и отношения IMCT к мышечной ткани. Гистологический анализ также показал, что увеличение IMCT в основном связано с утолщением эндомизия. Сосредоточившись на мышечно-сухожильном соединении, Zamora и Marini (1988) провели аналогичные эксперименты и изолировали подошвенную мышцу крысы с помощью тенотомии камбаловидной мышцы и удаления икроножных мышц.По сравнению с контрольными животными фибробласты, расположенные в мышечно-сухожильном соединении, развивали более высокую степень активации цитоплазмы, ядра и ядрышка уже после одной-двух недель функциональной перегрузки. В более позднем исследовании было проверено влияние ИЛ-6 на ремоделирование ВКМ, вызванное перегрузкой, путем сравнения мышей дикого типа и мышей с нокаутом по ИЛ-6 (White et al., 2009). В то время как увеличение площади поперечного сечения миофибрилл было одинаковым после 21 дня функциональной перегрузки, увеличение сырого веса мышц было значительно больше у мышей с нокаутом по IL-6.Гистологический анализ подтвердил, что этот избыточный прирост мышечной массы можно объяснить значительно большим увеличением содержания несократительной ткани и концентрации гидроксипролина, что свидетельствует о содержании коллагена и фиброзе. В соответствии с этим наблюдением, уровни мРНК проколлагена-1, IGF-1 и TGF-β были значительно выше у мышей с дефицитом IL-6. Напротив, экспрессия мРНК MyoD, фактора транскрипции, необходимого для мио-, а не фиброгенной дифференцировки сателлитных клеток (Zammit, 2017), была значительно ослаблена у животных, лишенных IL-6.В совокупности эти результаты показывают, что устранение синергиста вызывает увеличение содержания IMCT и, в частности, утолщение эндомизиальных структур в перегруженных мышцах. Эти адаптации могут служить для модуляции несокращающихся структур мышц в соответствии с повышенными функциональными требованиями. IGF-1, по-видимому, играет важную роль в регуляции этого процесса, поскольку было показано, что недостаток IGF-1 приводит к чрезмерному накоплению IMCT и, возможно, к нарушению регенеративного потенциала мышц.
Одно из первых исследований по тестированию и сравнению различных форм упражнений с отягощениями у мужчин было проведено Brown et al.(1999), которые сообщили, что после одного приступа концентрических сокращений маркеры распада коллагена (гидроксипролин и коллаген сывороточного типа I) не увеличивались. Напротив, эксцентрическое действие мышц увеличивало уровень коллагена в сыворотке более чем на 40% в течение 9 дней после тренировки, что указывает на то, что эксцентрические сокращения могут быть более эффективными в стимулировании распада коллагена. Эти результаты были подтверждены в двух более поздних исследованиях, аналогичным образом использовавшихся с использованием высокоинтенсивных эксцентрических упражнений, которые выявили как повышенный процессинг проколлагена и содержание коллагена типа IV, так и более высокую активность ММП и ТИМП (Crameri et al., 2004; Mackey et al., 2004). Интересно, что Crameri et al. (2004, 2007) также сообщили об увеличении тенасцина С, гликопротеина, присутствующего в ЕСМ, который, как предполагается, направляет миграцию клеток после повреждения, независимо от того, было ли повреждение мышц вызвано произвольным или электрически индуцированным повреждением мышц. Временное повышение активности тенасцина С и других гликопротеинов ЕСМ (например, фибронектина и гиалуроновой кислоты) обычно называют «переходной матрицей», появление которой считается важным первым шагом для успешного восстановления мышц, так как дает важные сигналы, управляющие регенеративный потенциал мышечных стволовых клеток (Calve et al., 2010; Tierney et al., 2016). Сообщается, что высвобождение гликопротеинов ECM сопровождается повышенной активностью MMP-9 у молодых, но снижением активности MMP-9 и MMP-15 у пожилых людей (Wessner et al., 2019). Эти данные свидетельствуют о том, что резкие упражнения с отягощениями вызывают катаболический ответ в молодых мышцах, но этот эффект может быть нарушен в более старшем возрасте. Последующая анаболическая реакция, характеризующаяся усилением регуляции структурных коллагенов (I, III, IV) и ламинина, как было обнаружено, происходит со значительной задержкой, что позволяет предположить, что восстановление мышц, вызванное острым приступом повреждающих (удлинительных) сокращений, следует за двухфазный характер (Mackey et al., 2011; Hyldahl et al., 2015). Интересно, что недавнее исследование Sorensen et al. (2018) обнаружили, что внешний вид переходной матрицы у физически активных пожилых людей притупляется по сравнению с молодыми людьми. Это наблюдение поддерживает идею о том, что дисрегулируемые сигналы ECM могут быть ответственны за увеличение отложения ECM и снижение активности стволовых клеток, обычно наблюдаемых в более старых мышцах (Grounds, 1998).
Одно из первых исследований по прямому сравнению различных форм мышечного сокращения с точки зрения их острого ремоделирующего потенциала ВКМ было опубликовано Heinemeier et al.(2007). Эти авторы провели исследование на грызунах и обнаружили, что активность генов, связанных с биосинтезом коллагена (например, коллагенов I и III), а также факторов роста (например, TGF-β1) повышается после всех форм физических упражнений, но в большей степени это происходит. после эксцентрической тренировки. У людей также было предложено увеличить скорость фракционного синтеза белка коллагена после острой эксцентрической тренировки по сравнению с концентрической тренировкой (Holm et al., 2017), хотя это понятие не бесспорно (Moore et al., 2005). В совокупности эти результаты предполагают, что особенно эксцентрические упражнения являются мощным стимулом, который вызывает микротравмы и обмен клеток IMCT, причем последний, как предполагается, представляет собой попытку организма предотвратить повторное повреждение мышцы (Mackey et al., 2011; Hyldahl et al. , 2015; Takagi et al., 2016). Фактически, снижение активности ММП после продолжительной тренировки, состоящей из электрически вызванных изометрических сокращений у крыс, может отражать успешное усиление ВКМ (Ogasawara et al., 2014), тогда как продолжительное повышение активности ММП и ТИМП в подошвенной мышце мышей после хирургического удаления икроножной и камбаловидной мышц может указывать на продолжающееся ремоделирование ВКМ (Mendias et al., 2017).
Помимо режима сокращения, ECM скелетных мышц также может быть чувствительным к интенсивности упражнений. Carmeli et al. (2005) протестировали влияние бега на беговой дорожке с высокой или низкой интенсивностью на крысах и обнаружили, что MMP-2 (один из ферментов, ответственных за расщепление коллагена IV, в основном присутствующего в базальной мембране мышц) повышается после упражнений высокой интенсивности. Только. На людях, напротив, одно исследование Holm et al. (2010) сравнивали эффекты односторонних упражнений на разгибание коленей, выполняемых с низкой или высокой (16% или 70% от индивидуального максимума одного повторения, соответственно) интенсивностью, с количеством повторений, скорректированным для соответствия вмешательствам для общей нагрузки. поднял.В этом исследовании скорость фракционного синтеза коллагена была равномерно увеличена после обоих вмешательств.
Что касается адаптации ЕСМ к длительным тренировкам с отягощениями, существуют только данные исследований на животных. де Соуза Нето и др. (2018) сообщили, что 12 недель тренировок с отягощениями, состоящих из подъемов по лестнице с прогрессивными дополнительными нагрузками, эквивалентными 65–100% максимальной несущей способности каждого индивидуума, активировали активность ММП-2 в подошвенных сгибательных мышцах старых крыс, в то же время подавляя ММП-2. 2 и ММП-9 в кровообращении.Вывод авторов о том, что тренировки с отягощениями могут, таким образом, быть полезным инструментом для поддержания ремоделирования ВКМ в более старшем возрасте, недавно получил эмпирическую поддержку в другом исследовании обучения на крысах, которое использовало тот же протокол обучения и показало пониженное отложение соединительной ткани у тренированных пожилых людей. мышцы (Guzzoni et al., 2018).
Подводя итог, можно сказать, что несколько исследований, посвященных изучению острых эффектов физической активности как у грызунов, так и у мужчин, показали, что упражнения могут стимулировать как деградацию, так и синтез коллагена в скелетных мышцах.Восстановление микротравм, вызванных физической нагрузкой, следует двухфазному паттерну, при котором гликопротеины сначала создают переходную матрицу для управления катаболическими процессами, а анаболические процессы, укрепляющие структуру IMCT, происходят со значительной задержкой. Потенциал упражнений для ремоделирования ВКМ, по-видимому, зависит от режима сокращения, при этом эксцентрические сокращения вызывают большую реакцию, чем концентрическое или изометрическое мышечное действие. Имеется немного исследований, в которых проверяются результаты упражнений с различной интенсивностью, и пока результаты показывают, что распад белка (но не синтез) может быть сильнее спровоцирован более высокой интенсивностью.Неиспользование резко снижает активность ферментов, связанных с биосинтезом коллагенов, хотя на уровне белка изменения происходят с медленной скоростью. Поперечные сравнения с участием (в основном тренированных на выносливость) грызунов показывают, что хроническая физическая активность может привести к усилению фенотипа ММКИ. Единственные доступные на сегодняшний день долгосрочные продольные обучающие исследования были выполнены на грызунах и предполагают, что длительные тренировки с отягощениями могут быть полезны для противодействия чрезмерному накоплению ММКИ в более старшем возрасте.Физиологические и функциональные последствия ремоделирования ММКИ, вызванного тренировкой, требуют дальнейшего изучения.
Заключение
Целью настоящего обзора является обзор современного состояния знаний о ECM скелетных мышц, который играет важную, хотя и часто недооцениваемую роль в поддержании мышечного гомеостаза, влияет на функцию мышц и адаптацию и может быть ключом к лечению. мышечных и метаболических нарушений, вызванных старением или болезнью.
Как сложная сеть различных коллагенов, гликопротеинов, протеогликанов и эластина, ECM включает сократительные мышечные волокна и через интегрины и гликопротеиновый комплекс, связанный с дистрофином, служит биохимическим и механическим интерфейсом между мышечными клетками и их окружением. Сборке его коллагенового каркаса в основном способствуют факторы роста TGF-β и CTGF, которые регулируются различными протеогликанами, такими как декорин и бигликан. Более того, протеолитические ферменты (MMP), а также их ингибиторы (TIMP) участвуют в регуляции ECM.
Функционально ECM служит средой для передачи сократительной силы, которая может служить не только для повышения эффективности мышечного сокращения, но также для защиты мышечных волокон от чрезмерного напряжения и облегчения заживления микротравм. Помимо своей функциональной роли, ЕСМ активно участвует в регуляции пула сателлитных клеток в мышцах. Ниши ВКМ, образовавшиеся между сарколеммой и базальной мембраной, защищают сателлитные клетки от входа в клеточный цикл и, таким образом, помогают поддерживать регенеративный потенциал мышц.Конкретные компоненты ЕСМ, такие как фибронектин, коллаген VI и различные протеогликаны, могут дополнительно способствовать делению стволовых клеток. И наоборот, ламинин, гликозаминогликаны и другие протеогликаны способствуют дифференцировке сателлитных клеток и их слиянию в зрелые миофибриллы.
Научные данные также демонстрируют, что ECM скелетных мышц является податливой тканью, которая может подвергаться процессам ремоделирования вследствие старения, болезней, физических тренировок или неиспользования.В частности, старение обычно приводит к общему увеличению отложения коллагеновой ткани, изменениям в составе коллагена (переход к более высокому типу коллагена I к типу III) и увеличению неферментативного сшивания коллагена (за счет конечных продуктов гликирования). Эти изменения, которые, возможно, опосредованы снижением активности ММП, приводят к усилению жесткости ECM мышцы и могут ухудшить функцию и регенеративный потенциал мышцы.
Ремоделирование внеклеточного матрикса также может быть связано с метаболическими нарушениями, такими как диабет.Было обнаружено, что чрезмерное потребление пищи приводит к повышенной экспрессии генов, связанных с ECM (коллагены I, III, IV, V, SPARC, интегрин). В свою очередь, такое ремоделирование может нарушать передачу сигналов интегрина, тем самым снижая чувствительность к инсулину. Другими компонентами ECM, потенциально представляющими мишени для инсулинорезистентности, являются гиалуронан, комплекс дистрофин-дистрогликан, а также MMP9.
Наконец, ремоделирование ECM может быть вызвано физическими упражнениями. Хотя фактических исследований тренировок немного, есть доказательства того, что упражнения могут резко способствовать как увеличению синтеза коллагена (коллагены I, III, TGF-β1), так и деградации (MMP2, MMP9).Поперечные исследования на людях и продольные исследования на грызунах также предполагают, что такой повышенный обмен коллагена может привести к усилению коллагеновых структур у хронически тренированных субъектов и предотвратить чрезмерное отложение коллагена (то есть фиброз) в мышцах пожилого возраста. Исследования, изучающие последствия длительного неиспользования, показали противоречивые результаты. В то время как в ранних исследованиях сообщалось о снижении активности гидроксилазы и содержания гидроксипролина после кратковременной иммобилизации, в более поздних работах было обнаружено повышенное содержание коллагена I после 21 дня разгрузки задних конечностей у крыс, но не изменилось после 60 дней постельного режима у людей.Необходимы дальнейшие исследования и, в частности, обучение людей, чтобы изучить влияние различных методов обучения на структуру и состав ECM.
Авторские взносы
RC участвовал в литературных исследованиях и подготовил рукопись. MG и BW внесли свой вклад в литературные исследования и отредактировали рукопись. Все авторы одобрили окончательную версию рукописи и согласились нести ответственность за все аспекты работы. Все лица, обозначенные как авторы, имеют право на авторство, и все, кто имеет право на авторство, перечислены в списке.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарны за финансовую поддержку этого исследования, полученную от Австрийского научного фонда (FWF): KLI 738-B27.
Список литературы
Aagaard, P., Andersen, J. L., Dyhre-Poulsen, P., Leffers, A.-M., Wagner, A., Магнуссон, С. П. и др. (2001). Механизм увеличения сократительной силы перистых мышц человека в ответ на силовую тренировку: изменения в архитектуре мышц. J. Physiol. 534, 613–623. DOI: 10.1111 / j.1469-7793.2001.t01-1-00613.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Адамс, Г. Р., Хазер, Б. М., Болдуин, К. М., и Дадли, Г. А. (1993). Состав тяжелых цепей миозина скелетных мышц и тренировки с отягощениями. J. Appl. Physiol. 74, 911–915. DOI: 10.1152 / jappl.1993.74.2.911
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Adstrum, S., Hedley, G., Schleip, R., Stecco, C., and Yucesoy, C.A. (2017). Определение фасциальной системы. J. Bodyw. Mov. Ther. 21, 173–177. DOI: 10.1016 / j.jbmt.2016.11.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Алмада, А. Э., и Вейджерс, А. Дж. (2016). Молекулярная схема судьбы стволовых клеток при регенерации скелетных мышц, старении и болезнях. Nat. Rev. Mol. Cell Biol. 17, 267–279. DOI: 10.1038 / nrm.2016.7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Американский колледж спортивной медицины. (2009). Позиционный стенд Американского колледжа спортивной медицины. Модели прогресса в тренировках с отягощениями для здоровых взрослых. Med. Sci. Спортивные упражнения. 41, 687–708. DOI: 10.1249 / mss.0b013e3181
0PubMed Аннотация | CrossRef Полный текст | Google Scholar
Азизи, Э., Деслорье, А.Р., Холт, Н. К., Итон, К. Э. (2017). Устойчивость к радиальному расширению ограничивает мышечное напряжение и работу. Biomech. Модель. Механобиол. 16, 1633–1643. DOI: 10.1007 / s10237-017-0909-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Багдади, М. Б., Кастель, Д., Мачадо, Л., Фукада, С., Бирк, Д. Э., Релэикс, Ф. и др. (2018). Реципрокная передача сигналов с помощью Notch-Collagen V-CALCR удерживает мышечные стволовые клетки в их нише. Природа 557, 714–718. DOI: 10.1038 / s41586-018-0144-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барретт Б. (1962). Длина и способ окончания отдельных мышечных волокон портняжной и задней бедренной мышцы человека. Acta Anat. 48, 242–257. DOI: 10.1159 / 000141843
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенцингер, К. Ф., Ван, Ю. X., Дюмон, Н. А., и Рудницки, М. А. (2013a). Клеточная динамика в нише мышечных сателлитных клеток. EMBO Rep. 14, 1062–1072. DOI: 10.1038 / embor.2013.182
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенцингер, К. Ф., Ван, Ю. X., фон Мальцан, Дж., Сулеймани, В. Д., Инь, Х., и Рудницки, М. А. (2013b). Фибронектин регулирует передачу сигналов Wnt7a и рост сателлитных клеток. Cell Stem Cell 12, 75–87. DOI: 10.1016 / j.stem.2012.09.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Берриа, Р., Ван, Л., Ричардсон, Д. К., Финлейсон, Дж., Белфорт, Р., Пратипанаватр, Т. и др. (2006). Повышенное содержание коллагена в инсулинорезистентных скелетных мышцах. Am. J. Physiol. Эндокринол. Метаб. 290, E560 – E565. DOI: 10.1152 / ajpendo.00202.2005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Блох, Р. Дж., И Гонсалес-Серратос, Х. (2003). Передача боковой силы через костамеры в скелетных мышцах. Exerc. Sport Sci. Ред. 31, 73–78. DOI: 10.1097 / 00003677-200304000-00004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боонен, К.Дж. М., Розария-Чак, К. Ю., Баайенс, Ф. П. Т., ван дер Шафт, Д. В. Дж., И Пост, М. Дж. (2009). Важнейшие экологические сигналы из ниши сателлитных клеток: оптимизация пролиферации и дифференцировки. Am. J. Physiol. Cell Physiol. 296, C1338 – C1345. DOI: 10.1152 / ajpcell.00015.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боппарт, М. Д., и Махмассани, З. С. (2019). Передача сигналов интегрина: связь механической стимуляции с гипертрофией скелетных мышц. Am. J. Physiol. Cell Physiol. 317, C629 – C641. DOI: 10.1152 / ajpcell.00009.2019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брак А. С., Конбой И. М., Конбой М. Дж., Шен Дж. И Рандо Т. А. (2008). Временное переключение с передачи сигналов notch на Wnt в мышечных стволовых клетках необходимо для нормального миогенеза взрослых. Cell Stem Cell 2, 50–59. DOI: 10.1016 / j.stem.2007.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брак, А.С., Конбой, М. Дж., Рой, С., Ли, М., Куо, К. Дж., Келлер, К. и др. (2007). Повышенная передача сигналов Wnt во время старения изменяет судьбу мышечных стволовых клеток и увеличивает фиброз. Наука 317, 807–810. DOI: 10.1126 / science.1144090
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brandan, E., Cabello-Verrugio, C., and Vial, C. (2008). Новые механизмы регуляции протеогликанов, декорина и бигликана во время формирования мышц и мышечной дистрофии. Matrix Biol. 27, 700–708. DOI: 10.1016 / j.matbio.2008.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brandt, P. W., Lopez, E., Reuben, J. P., and Grundfest, H. (1967). Взаимосвязь между плотностью упаковки миофиламентов и длиной саркомера в поперечнополосатой мышце лягушки. J. Cell Biol. 33, 255–263. DOI: 10.1083 / jcb.33.2.255
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Браун С., Дэй С. и Доннелли А. (1999).Косвенные доказательства повреждения скелетных мышц человека и распада коллагена после эксцентрических действий мышц. J. Sports Sci. 17, 397–402. DOI: 10.1080 / 0264041911
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бушби, К. М., Коллинз, Дж., И Хикс, Д. (2014). «Миопатии коллагенового типа VI», Progress in Heritage Soft Connective Tissue Diseases , ed. Дж. Халпер, (Дордрехт: Спрингер), 185–199. DOI: 10.1007 / 978-94-007-7893-1_12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Calve, S., Одельберг, С. Дж., И Саймон, Х.-Г. (2010). Переходный внеклеточный матрикс определяет поведение клеток во время регенерации мышц. Dev. Биол. 344, 259–271. DOI: 10.1016 / j.ydbio.2010.05.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кальво, А.С., Морено, Л., Морено, Л., Тойвонен, Дж. М., Манзано, Р., Молина, Н. и др. (2020). Коллаген типа XIX: перспективный биомаркер базальных мембран. Neural Regen. Res. 15, 988–995. DOI: 10.4103 / 1673-5374.270299
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кармели, Э., Моас, М., Леннон, С., и Пауэрс, С. К. (2005). Упражнения высокой интенсивности увеличивают экспрессию матричных металлопротеиназ в быстрых волокнах скелетных мышц: упражнения и ММП в быстрых волокнах скелета. Exp. Physiol. 90, 613–619. DOI: 10.1113 / expphysiol.2004.029462
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарве, Б., Гиро, А., Malbouyres, M., Zwolanek, D., Guillon, E., Bretaud, S., et al. (2013). Нокдаун гена col22a1 у рыбок данио вызывает мышечную дистрофию за счет нарушения мышечно-сухожильного соединения. Dev. Camb. Англ. 140, 4602–4613. DOI: 10.1242 / dev.096024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чике М., Бирк Д. Э., Беннеманн К. Г. и Кох М. (2014). Коллаген XII: защита целостности костей и мышц за счет организации фибрилл коллагена. Внутр. Дж.Biochem. Cell Biol. 53, 51–54. DOI: 10.1016 / j.biocel.2014.04.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристенсен, С., Пурслоу, П. П. (2016). Роль матриксных металлопротеиназ в развитии мышечной и жировой ткани и качестве мяса: обзор. Meat Sci. 119, 138–146. DOI: 10.1016 / j.meatsci.2016.04.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коркоран, М. Л., Хьюитт, Р. Э., Кляйнер, Д.Э. младший и Стетлер-Стивенсон У. Г. (1996). ММП-2: экспрессия, активация и ингибирование. Ферментный белок 49, 7–19. DOI: 10.1159 / 000468613
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корнелисон, Д. Д., Филла, М. С., Стэнли, Х. М., Рапрэгер, А. С., и Олвин, Б. Б. (2001). Синдекан-3 и синдекан-4 специфически маркируют сателлитные клетки скелетных мышц и участвуют в поддержании сателлитных клеток и регенерации мышц. Dev. Биол. 239, 79–94.DOI: 10.1006 / dbio.2001.0416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Косгроув, Б. Д., Гилберт, П. М., Порпилья, Э., Муркиоти, Ф., Ли, С. П., Корбел, С. Ю. и др. (2014). Омоложение популяции мышечных стволовых клеток восстанавливает силу травмированных старых мышц. Nat. Med. 20, 255–264. DOI: 10,1038 / нм 3464
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Crameri, R.M., Aagaard, P., Qvortrup, K., Langberg, H., Олесен, Дж., И Кьяер, М. (2007). Повреждение миофибрилл в скелетных мышцах человека: эффекты электростимуляции по сравнению с произвольным сокращением : равномерная по сравнению с гетерогенной активацией мышечных волокон. J. Physiol. 583, 365–380. DOI: 10.1113 / jphysiol.2007.128827
CrossRef Полный текст | Google Scholar
Crameri, R.M., Langberg, H., Teisner, B., Magnusson, P., Schrøder, H.D., Olesen, J.L., et al. (2004). Усиление обработки проколлагена в скелетных мышцах после однократной эксцентрической нагрузки у людей. Matrix Biol. 23, 259–264. DOI: 10.1016 / j.matbio.2004.05.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, Н., Ху, М., и Халил, Р. А. (2017). Биохимические и биологические признаки матричных металлопротеиназ. Прог. Мол. Биол. Пер. Sci. 147, 1–73. DOI: 10.1016 / bs.pmbts.2017.02.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
де Соуза Нето, И. В., Дуриган, Дж. Л. К., Гуццони, В., Тибана, Р.A., Prestes, J., de Araujo, H. S. S. и др. (2018). Влияние тренировок с отягощениями на активность матричной металлопротеиназы в скелетных мышцах и кровообращение при старении. Фронт. Physiol. 9: 190. DOI: 10.3389 / fphys.2018.00190
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дитрих, А. В., Боттер, А., Виейра, Т. М., Пеолссон, А., Петцке, Ф., Дэйви, П. и др. (2017). Пространственная вариация и несоответствие между оценками начала мышечной активации по ЭМГ и УЗИ. Sci. Реп. 7: 42011. DOI: 10.1038 / srep42011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dietrich, S., Abou-Rebyeh, F., Brohmann, H., Bladt, F., Sonnenberg-Riethmacher, E., Yamaai, T., et al. (1999). Роль SF / HGF и c-Met в развитии скелетных мышц. Dev. Camb. Англ. 126, 1621–1629.
PubMed Аннотация | Google Scholar
Duance, V.C., Restall, D.J., Beard, H., Bourne, F.J., и Bailey, A.J. (1977). Расположение трех типов коллагена в скелетных мышцах. FEBS Lett. 79, 248–252. DOI: 10.1016 / 0014-5793 (77) 80797-7
CrossRef Полный текст | Google Scholar
Эклунд, Л., Пиухола, Дж., Комулайнен, Дж., Сормунен, Р., Онгваррасопоне, К., Фасслер, Р., и др. (2001). Недостаток коллагена типа XV вызывает у мышей скелетную миопатию и сердечно-сосудистые дефекты. Proc. Natl. Акад. Sci. США 98, 1194–1199. DOI: 10.1073 / pnas.031444798
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Энглер, А.Дж., Гриффин, М. А., Сен, С., Беннеман, К. Г., Суини, Х. Л. и Дишер, Д. Е. (2004). Миотрубки оптимально дифференцируются на субстратах с тканевой жесткостью: патологические последствия для мягких или жестких микроокружений. J. Cell Biol. 166, 877–887. DOI: 10.1083 / jcb.200405004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Этьен, Дж., Лю, К., Скиннер, К. М., Конбой, М. Дж., И Конбой, И. М. (2020). Скелетные мышцы как экспериментальная модель выбора для изучения старения и омоложения тканей. Скелет. Мышца 10: 4. DOI: 10.1186 / s13395-020-0222-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фишер, Дж., Стил, Дж., Брюс-Лоу, С., и Смит, Д. (2011). Рекомендации по тренировкам с отягощениями, основанные на фактах. Med. Спорт. 15, 147–162. DOI: 10.2478 / v10036-011-0025-x
CrossRef Полный текст | Google Scholar
Фолланд, Дж. П., и Уильямс, А. Г. (2007). Адаптация к силовым тренировкам: морфологический и неврологический вклад в увеличение силы. Sports Med. 37, 145–168. DOI: 10.2165 / 00007256-200737020-00004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрай, К. С., Кирби, Т. Дж., Космак, К., Маккарти, Дж. Дж., И Петерсон, К. А. (2017). Миогенные клетки-предшественники контролируют продукцию внеклеточного матрикса фибробластами во время гипертрофии скелетных мышц. Cell Stem Cell 20, 56–69. DOI: 10.1016 / j.stem.2016.09.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гарбер, К.E., Blissmer, B., Deschenes, M. R., Franklin, B. A., Lamonte, M. J., Lee, I.-M., et al. (2011). Количество и качество упражнений для развития и поддержания кардиореспираторной, скелетно-мышечной и нейромоторной формы у практически здоровых взрослых: руководство по назначению упражнений. Med. Sci. Спортивные упражнения. 43, 1334–1359. DOI: 10.1249 / MSS.0b013e318213fefb
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гилберт, П. М., Хэвенстрайт, К. Л., Магнуссон, К.Э. Г., Сакко А., Леонарди Н. А., Крафт П. и др. (2010). Эластичность субстрата регулирует самообновление стволовых клеток скелетных мышц в культуре. Science 329, 1078–1081. DOI: 10.1126 / science.11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гиллис, А. Р., Чепмен, М. А., Бушонг, Э. А., Диринк, Т. Дж., Эллисман, М. Х., и Либер, Р. Л. (2017). Трехмерная реконструкция с высоким разрешением внеклеточного матрикса фиброзных скелетных мышц: организация внеклеточного матрикса фиброзных мышц. J. Physiol. 595, 1159–1171. DOI: 10.1113 / JP273376
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Госселин, Л. Е., Адамс, К., Коттер, Т. А., Маккормик, Р. Дж., И Томас, Д. П. (1998). Влияние физических упражнений на пассивную жесткость опорно-двигательных скелетных мышц: роль внеклеточного матрикса. J. Appl. Physiol. 85, 1011–1016. DOI: 10.1152 / jappl.1998.85.3.1011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Грефте, С., Vullinghs, S., Kuijpers-Jagtman, A.M., Torensma, R., and Von den Hoff, J. W. (2012). Матригель, но не коллаген I, поддерживает способность к дифференцировке мышечных клеток in vitro . Биомед. Матер. 7: 055004. DOI: 10.1088 / 1748-6041 / 7/5/055004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Grounds, M. D. (1998). Возрастные изменения реакции клеток скелетных мышц на упражнения и регенерацию. Ann. Акад.Sci. 854, 78–91. DOI: 10.1111 / j.1749-6632.1998.tb09894.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Основания, М. Д., Сорокин, Л., Уайт, Дж. (2005). Сила на границе межклеточного матрикса и мышцы. Сканд. J. Med. Sci. Спорт 15, 381–391. DOI: 10.1111 / j.1600-0838.2005.00467.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гийон, Э., Брето, С., Руджеро, Ф. (2016). Предшественники медленных мышц откладывают отпечаток пальца матрицы XV коллагена, чтобы направлять навигацию по моторным аксонам. J. Neurosci. 36, 2663–2676. DOI: 10.1523 / JNEUROSCI.2847-15.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гутьеррес, Дж., И Брандан, Э. (2010). Новый механизм связывания фактора роста фибробластов 2 с помощью глипикана в липидных рафтах, позволяющий дифференцировать скелетные мышцы. Мол. Клетка. Биол. 30, 1634–1649. DOI: 10.1128 / mcb.01164-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуццони, В., Рибейро, М.Б. Т., Лопес, Г. Н., де Касиа Маркети, Р., де Андраде, Р. В., Селистр-де-Араужо, Х. С. и др. (2018). Влияние тренировки с отягощениями на адаптацию внеклеточного матрикса в скелетных мышцах старых крыс. Фронт. Physiol. 9: 374. DOI: 10.3389 / fphys.2018.00374
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Халпер, Дж., И Кьяер, М. (2014). «Основные компоненты соединительной ткани и внеклеточного матрикса: эластин, фибриллин, фибулины, фибриноген, фибронектин, ламинин, тенасцины и тромбоспондины», в Progress in Heritable Soft Connective Tissue Diseases , ed.Дж. Халпер, (Дордрехт: Спрингер), 31–47. DOI: 10.1007 / 978-94-007-7893-1_3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Härönen, H., Zainul, Z., Tu, H., Naumenko, N., Sormunen, R., Miinalainen, I., et al. (2017). Коллаген XIII обеспечивает пре- и постсинаптическую целостность нервно-мышечного синапса. Хум. Мол. Genet. 26, 2076–2090. DOI: 10.1093 / hmg / ddx101
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хассон П., ДеЛорье А., Беннетт, М., Григорьева, Э., Найче, Л. А., Папайоанну, В. Э. и др. (2010). Tbx4 и tbx5, действующие в соединительной ткани, необходимы для формирования рисунка мышц конечностей и сухожилий. Dev. Cell 18, 148–156. DOI: 10.1016 / j.devcel.2009.11.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаус, Дж. М., Карритерс, Дж. А., Кэрролл, К. К., Теш, П. А., и Трапп, Т. А. (2007a). Содержание белка сократительной и соединительной ткани в скелетных мышцах человека: эффекты 35- и 90-дневного моделирования микрогравитации и контрмеры при физической нагрузке. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 293, R1722 – R1727. DOI: 10.1152 / ajpregu.00292.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хаус, Дж. М., Карритерс, Дж. А., Траппе, С. У. и Трапп, Т. А. (2007b). Коллаген, сшивание и конечные продукты гликирования в стареющих скелетных мышцах человека. J. Appl. Physiol. 103, 2068–2076. DOI: 10.1152 / japplphysiol.00670.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейккинен, А., Härönen, H., Norman, O., and Pihlajaniemi, T. (2019). Коллаген XIII и другие компоненты ECM в сборке и заболевании нервно-мышечного соединения. Анат. Рек. doi: 10.1002 / ar.24092 [Epub перед печатью].
CrossRef Полный текст | PubMed Аннотация | Google Scholar
Heinemeier, K. M., Olesen, J. L., Haddad, F., Langberg, H., Kjaer, M., Baldwin, K. M., et al. (2007). Экспрессия коллагена и родственных факторов роста в сухожилиях и скелетных мышцах крысы в ответ на определенные типы сокращения: экспрессия коллагена и TGF-β-1 в тренированных сухожилиях и мышцах. J. Physiol. 582, 1303–1316. DOI: 10.1113 / jphysiol.2007.127639
CrossRef Полный текст | Google Scholar
Heljasvaara, R., Aikio, M., Ruotsalainen, H., and Pihlajaniemi, T. (2017). Коллаген XVIII в гомеостазе и нарушении регуляции тканей — уроки, извлеченные из модельных организмов и пациентов-людей. Matrix Biol. 57–58, 55–75. DOI: 10.1016 / j.matbio.2016.10.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хидзиката, Т., Вакисака Х. и Ниида С. (1993). Функциональная комбинация сужающихся профилей и перекрывающихся расположений в нерасширяющихся волокнах скелетных мышц, оканчивающихся внутрипучкообразно. Анат. Рек. 236, 602–610. DOI: 10.1002 / ar.10403
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хиндл, А.Г., Хорнинг, М., Меллиш, Дж .-А. Э. и Лоулер Дж. М. (2009). Погружение в старость: мускульное старение у крупнотелого долгоживущего млекопитающего, тюленя Уэдделла ( Leptonychotes weddellii ). J. Exp. Биол. 212, 790–796. DOI: 10.1242 / jeb.025387
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холм Л., Рахбек С. К., Фаруп Дж., Вендельбо М. Х. и Виссинг К. (2017). Режим сокращения и потребление сывороточного протеина влияют на скорость синтеза внутримышечной соединительной ткани: краткие отчеты. Мышечный нерв 55, 128–130. DOI: 10.1002 / mus.25398
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холм, Л., ван Холл, Г., Роуз, А. Дж., Миллер, Б. Ф., Дёссинг, С., Рихтер, Э. А. и др. (2010). Интенсивность сокращения и питание по-разному влияют на скорость синтеза коллагена и миофибриллярного белка в скелетных мышцах человека. Am. J. Physiol. Эндокринол. Метаб. 298, E257 – E269. DOI: 10.1152 / ajpendo.00609.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, Ю., Фан, Ю., Саланова, М., Янг, X., Сан, Л., и Блоттнер, Д. (2018). Влияние подошвенной вибрации на кости и глубокую фасцию в модели неиспользования разгрузки задней конечности крысы. Фронт. Physiol. 9: 616. DOI: 10.3389 / fphys.2018.00616
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хьюз, Д. К., Маркотт, Г. Р., Маршалл, А. Г., Уэст, Д. В. Д., Баер, Л. М., Уоллес, М. А., и др. (2016). Возрастные различия дистрофина: влияние на белки передачи силы, целостность мембран и стабильность нервно-мышечных соединений. J. Gerontol. A. Biol. Sci. Med. Sci. 72, 640–648. DOI: 10.1093 / gerona / glw109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуцзин, П.А. (1999). Мышцы как композит, армированный коллагеновыми волокнами: обзор передачи силы в мышце и всей конечности. J. Biomech. 32, 329–345. DOI: 10.1016 / s0021-9290 (98) 00186-9
CrossRef Полный текст | Google Scholar
Хьюцзин П.А., Баан Г.С. и Ребел Г.Т. (1998). Немышухожильная передача силы в длинном разгибателе пальцев большого пальца крысы. J. Exp. Биол. 201, 683–691.
Google Scholar
Хилдал, Р. Д., Нельсон, Б., Xin, L., Welling, T., Groscost, L., Hubal, M.J., et al. (2015). Ремоделирование внеклеточного матрикса и его вклад в защитную адаптацию после удлинения сокращений в мышцах человека. FASEB J. 29, 2894–2904. DOI: 10.1096 / fj.14-266668
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ивата, Дж., Судзуки, А., Пеликан, Р. К., Хо, Т.-В., и Чай, Ю. (2013). Передача сигналов неканонического трансформирующего фактора роста β (TGFβ) в клетках краниального нервного гребня вызывает дефекты развития мышц языка. J. Biol. Chem. 288, 29760–29770. DOI: 10.1074 / jbc.M113.4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Якобсен, Дж. Р., Макки, А. Л., Кнудсен, А. Б., Кох, М., Кьяер, М., и Крогсгаард, М. Р. (2017). Состав и адаптация мышечно-сухожильных суставов человека и соседних мышечных волокон к тяжелым тренировкам с отягощениями. Сканд. J. Med. Sci. Спорт 27, 1547–1559. DOI: 10.1111 / sms.12794
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яначек, Я., Цебашек, В., Кубинова, Л., Рибарич, С., и Эрзен, И. (2009). Трехмерная визуализация и измерение капилляров, снабжающих метаболически различные типы волокон в длинном разгибателе пальцев большого пальца крысы во время денервации и реиннервации. J. Histochem. Cytochem. 57, 437–447. DOI: 10.1369 / jhc.2008.953018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ярвинен, Т. А. Х., Йожа, Л., Каннус, П., Ярвинен, Т. Л. Н., и Ярвинен, М. (2002). Организация и распределение внутримышечной соединительной ткани в нормальных и неподвижных скелетных мышцах.Иммуногистохимическое, поляризационное и сканирующее электронно-микроскопические исследования. J. Muscle Res. Cell Motil. 23, 245–254. DOI: 10.1023 / A: 10208336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канг, Л., Лантье, Л., Кеннеди, А., Боннер, Дж. С., Мэйс, В. Х., Брейси, Д. П. и др. (2013). Гиалуронан накапливается при кормлении с высоким содержанием жиров и способствует развитию инсулинорезистентности. Диабет 62, 1888–1896. DOI: 10.2337 / db12-1502
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канг, Л., Мэйс, У. Х., Джеймс, Ф. Д., Брейси, Д. П., и Вассерман, Д. Х. (2014). Матричная металлопротеиназа 9 противодействует индуцированной диетой мышечной инсулинорезистентности у мышей. Диабетология 57, 603–613. DOI: 10.1007 / s00125-013-3128-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кардон, Г., Харф, Б. Д. и Табин, К. Дж. (2003). Tcf4-позитивная мезодермальная популяция обеспечивает предпаттерн для формирования мышечного паттерна конечностей позвоночных. Dev. Мобильный 5, 937–944. DOI: 10.1016 / с 1534-5807 (03) 00360-5
CrossRef Полный текст | Google Scholar
Карпакка Й., Вяэнянен К., Орава С. и Такала Т. Э. (1990). Эффекты предварительной иммобилизации и иммобилизации на синтез коллагена в скелетных мышцах крыс. Внутр. J. Sports Med. 11, 484–488. DOI: 10.1055 / с-2007-1024842
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Карпакка, Дж., Виртанен, П., Ваананен, К., Орава, С., и Такала, Т. Е. (1991).Синтез коллагена в скелетных мышцах крысы во время иммобилизации и ремобилизации. J. Appl. Physiol. 70, 1775–1780. DOI: 10.1152 / jappl.1991.70.4.1775
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Khaleduzzaman, M., Sumiyoshi, H., Ueki, Y., Inoguchi, K., Ninomiya, Y., and Yoshioka, H. (1997). Структура гена коллагена человека типа XIX (COL19A1), которая предполагает, что он произошел от гена-предка семейства FACIT. Genomics 45, 304–312.DOI: 10.1006 / geno.1997.4921
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким Дж., Ван З., Хеймсфилд С. Б., Баумгартнер Р. Н. и Галлахер Д. (2002). Общая масса скелетных мышц: оценка с помощью нового метода двухэнергетической рентгеновской абсорбциометрии. Am. J. Clin. Nutr. 76, 378–383. DOI: 10.1093 / ajcn / 76.2.378
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кнудсен, А.Б., Ларсен, М., Макки, А.Л., Хьорт, М., Hansen, K. K., Qvortrup, K., et al. (2015). Человеческое мышечно-сухожильное соединение: ультраструктурное исследование и трехмерный анализ. Сканд. J. Med. Sci. Sports 25, e116 – e123. DOI: 10.1111 / sms.12221
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Koch, M., Schulze, J., Hansen, U., Ashwodt, T., Keene, D.R., Brunken, W.J., et al. (2004). Новый маркер тканевых соединений, коллаген XXII. J. Biol. Chem. 279, 22514–22521. DOI: 10.1074 / jbc.M400536200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кованен, В., Суоминен, Х., Ристели, Дж., И Ристели, Л. (1988). Коллаген IV типа и ламинин в медленных и быстрых скелетных мышцах крыс — Влияние возраста и тренировок на выносливость на протяжении всей жизни. Сб. Relat. Res. 8, 145–153. DOI: 10,1016 / s0174-173x (88) 80026-8
CrossRef Полный текст | Google Scholar
Куо, Х. Дж., Маслен, К. Л., Кин, Д. Р., и Гланвилл, Р. У. (1997). Коллаген VI типа закрепляет базальные мембраны эндотелия, взаимодействуя с коллагеном IV типа. J. Biol. Chem. 272, 26522–26529. DOI: 10.1074 / jbc.272.42.26522
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леонг, Д. П., Тео, К. К., Рангараджан, С., Лопес-Харамилло, П., Авесум, А., Орландини, А., и др. (2015). Прогностическое значение силы хвата: результаты проспективного исследования городской и сельской эпидемиологии (PURE). Lancet Lond. Англ. 386, 266–273. DOI: 10,1016 / s0140-6736 (14) 62000-6
CrossRef Полный текст | Google Scholar
Ли, Дж.Дж., Виттерт, Г. А., Винсент, А., Атлантис, Э., Ши, З., Эпплтон, С. Л. и др. (2016). Сила мышечного захвата позволяет прогнозировать развитие диабета 2 типа: популяционное когортное исследование. Метаболизм 65, 883–892. DOI: 10.1016 / j.metabol.2016.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Либер, Р. Л., и Уорд, С. Р. (2013). Клеточные механизмы тканевого фиброза. 4. Структурные и функциональные последствия фиброза скелетных мышц. Am. J. Physiol.Cell Physiol. 305, C241 – C252. DOI: 10.1152 / ajpcell.00173.2013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лопес-Отин, К., Бласко, М. А., Партридж, Л., Серрано, М., и Кремер, Г. (2013). Признаки старения. Мобильный 153, 1194–1217. DOI: 10.1016 / j.cell.2013.05.039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Maaß, T., Bayley, C.P., Mörgelin, M., Lettmann, S., Bonaldo, P., Paulsson, M., et al. (2016).Неоднородность микрофибрилл коллагена VI: структурный анализ неколлагеновых участков. J. Biol. Chem. 291, 5247–5258. DOI: 10.1074 / jbc.M115.705160
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mackey, A. L., Brandstetter, S., Schjerling, P., Bojsen-Moller, J., Qvortrup, K., Pedersen, M. M., et al. (2011). Последовательный ответ мертвых клеток внеклеточного матрикса и фиброзных регуляторов после повреждения мышц участвует в защите скелетных мышц человека от будущих повреждений. FASEB J. 25, 1943–1959. DOI: 10.1096 / fj.10-176487
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mackey, A. L., Donnelly, A. E., Turpeenniemi-Hujanen, T., and Roper, H.P. (2004). Содержание коллагена в скелетных мышцах у людей после эксцентрических сокращений большой силы. J. Appl. Physiol. 97, 197–203. DOI: 10.1152 / japplphysiol.01174.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махновский П.А., Згода В.Г., Боков Р.О., Шагимарданова Е.И., Газизова Г.Р., Гусев О.А. и др. (2020). Регуляция белков в скелетных мышцах человека: роль транскрипции. Sci. Реп. 10: 3514.
Google Scholar
Мартин, Г. Р., и Тимпл, Р. (1987). Ламинин и другие компоненты базальной мембраны. Annu. Rev. Cell Biol. 3, 57–85. DOI: 10.1146 / annurev.cb.03.110187.000421
CrossRef Полный текст | Google Scholar
Макки, Т. Дж., Перлман, Г., Моррис, М., Комарова, С. В. (2019). Состав внеклеточного матрикса соединительной ткани: систематический обзор и метаанализ. Sci. Реп. 9: 10542.
Google Scholar
Мендиас, К. Л., Шварц, А. Дж., Грекин, Дж. А., Гумусио, Дж. П., и Сугг, К. Б. (2017). Изменения сократимости мышечных волокон и продукции внеклеточного матрикса при гипертрофии скелетных мышц. J. Appl. Physiol. 122, 571–579. DOI: 10.1152 / japplphysiol.00719.2016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монти, Р.Дж., Рой, Р. Р., Ходжсон, Дж. А., и Реджи Эджертон, В. (1999). Передача сил в скелетных мышцах млекопитающих. J. Biomech. 32, 371–380. DOI: 10.1016 / s0021-9290 (98) 00189-4
CrossRef Полный текст | Google Scholar
Мур, Д. Р., Филлипс, С. М., Бабрадж, Дж. А., Смит, К., и Ренни, М. Дж. (2005). Синтез миофибриллярных и коллагеновых белков в скелетных мышцах человека у молодых мужчин после максимального сокращения и удлинения сокращений. Am. J. Physiol.Эндокринол. Метаб. 288, E1153 – E1159. DOI: 10.1152 / ajpendo.00387.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моралес, М. Г., Кабелло-Верругио, К., Сантандер, К., Кабрера, Д., Гольдшмединг, Р., и Брандан, Э. (2011). Сверхэкспрессия CTGF / CCN-2 может напрямую вызывать признаки дистрофии скелетных мышц. J. Pathol. 225, 490–501. DOI: 10.1002 / путь.2952
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Малви, К., Харно, Э., Кинан, А., и Олендик, К. (2005). Экспрессия комплекса дистрофин-дистрогликан скелетных мышц и комплекса синтрофин-оксид азота серьезно нарушена у крыс Goto-Kakizaki с диабетом 2 типа. Eur. J. Cell Biol. 84, 867–883. DOI: 10.1016 / j.ejcb.2005.06.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Наба А., Клаузер К. Р., Динг Х., Уиттакер К. А., Карр С. А. и Хайнс Р. О. (2016). Внеклеточный матрикс: инструменты и идеи для эпохи «омиков». Matrix Biol. 49, 10–24. DOI: 10.1016 / j.matbio.2015.06.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нассари, С., Дюпре, Д., Фурнье-Тибо, К. (2017). Немиогенный вклад в развитие мышц и гомеостаз: роль соединительной ткани. Фронт. Cell Dev. Биол. 5:22. DOI: 10.3389 / fcell.2017.00022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Nordez, A., Gallot, T., Catheline, S., Гевель А., Корню К. и Хуг Ф. (2009). Повторно рассмотрена электромеханическая задержка с использованием ультразвука с очень высокой частотой кадров. J. Appl. Physiol. 106, 1970–1975. DOI: 10.1152 / japplphysiol.00221.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новицки Дж. Л., Такимото Р. и Берк А. С. (2003). Латеральная сомитическая граница: дорсо-вентральные аспекты передне-задней регионализации у эмбрионов птиц. Mech. Dev. 120, 227–240. DOI: 10.1016 / s0925-4773 (02) 00415-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Огасавара, Р., Наказато К., Сато К., Боппарт М. Д. и Фудзита С. (2014). Упражнения с отягощениями увеличивают экспрессию активного белка MMP и бета1-интегрина в скелетных мышцах. Physiol. Реп. 2: e12212. DOI: 10.14814 / phy2.12212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Olguin, H.C., и Olwin, B.B. (2004). Повышающая регуляция Pax-7 ингибирует миогенез и прогрессию клеточного цикла в сателлитных клетках: потенциальный механизм самообновления. Dev. Биол. 275, 375–388.DOI: 10.1016 / j.ydbio.2004.08.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Олссон, Л., Фальк, П., Лопес, К., Кобб, Дж., И Ханкен, Дж. (2001). Клетки черепного нервного гребня вносят вклад в соединительную ткань в черепных мышцах бесхвостых амфибий, Bombina orientalis . Dev. Биол. 237, 354–367. DOI: 10.1006 / dbio.2001.0377
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Passerieux, E., Rossignol, R., Летелье, Т., и Делаж, Дж. (2007). Физическая непрерывность перимизиума от миофибрилл к сухожилиям: участие в передаче латеральной силы в скелетных мышцах. J. Struct. Биол. 159, 19–28. DOI: 10.1016 / j.jsb.2007.01.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паттисон, Дж. С., Фолк, Л. К., Мэдсен, Р. У., Чайлдс, Т. Э. и Бут, Ф. У. (2003). Транскрипционное профилирование выявляет обширное подавление экспрессии гена внеклеточного матрикса в саркопенической камбаловидной мышце крысы. Physiol. Геномика 15, 34–43. DOI: 10.1152 / Physiolgenomics.00040.2003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паван, П. Г., Стекко, А., Стерн, Р., и Стекко, К. (2014). Болезненные связи: уплотнение или фиброз фасции. Curr. Боль Головная боль Rep. 18: 441.
Google Scholar
Пирс, Р. В., Шерц, П. Дж., Кэмпбелл, Дж. К., и Табин, К. Дж. (2007). Анализ клеточного происхождения зачатка куриной конечности. Dev. Биол. 310, 388–400. DOI: 10.1016 / j.ydbio.2007.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Питер А. К., Ченг Х., Росс Р. С., Ноултон К. У. и Чен Дж. (2011). Костамер соединяет саркомеры с сарколеммой поперечно-полосатой мышцы. Прог. Педиатр. Кардиол. 31, 83–88. DOI: 10.1016 / j.ppedcard.2011.02.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пурслоу П. П. (2002). Структура и функциональное значение изменений соединительной ткани в мышце. Комп. Biochem. Physiol. Мол. Интегр. Physiol. 133, 947–966. DOI: 10.1016 / s1095-6433 (02) 00141-1
CrossRef Полный текст | Google Scholar
Рамасвами, К. С., Палмер, М. Л., ван дер Мейлен, Дж. Х., Рену, А., Костроминова, Т. Ю., Мишель, Д. Е. и др. (2011). Боковая передача силы нарушена в скелетных мышцах дистрофических мышей и очень старых крыс: латеральная передача силы в скелетных мышцах мышей и крыс. J. Physiol. 589, 1195–1208.DOI: 10.1113 / jphysiol.2010.201921
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райагири, С.С., Ранальди, Д., Рэйвен, А., Мохамад Азхар, Н.И.Ф., Лефевр, О., Заммит, П.С. и др. (2018). Ремоделирование базальной пластинки в нише стволовых клеток скелетных мышц опосредует самообновление стволовых клеток. Nat. Commun. 9: 1075.
Google Scholar
Риз, С. П., Андервуд, К. Дж., И Вайс, Дж. А. (2013). Влияние протеогликана декорина на фибриллогенез, ультраструктуру и механику коллагеновых гелей типа I. Matrix Biol. 32, 414–423. DOI: 10.1016 / j.matbio.2013.04.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Реннинг, С. Б., Педерсен, М. Э., Андерсен, П. В., и Холлунг, К. (2013). Комбинация гликозаминогликанов и фиброзных белков улучшает пролиферацию клеток и раннюю дифференциацию первичных клеток скелетных мышц крупного рогатого скота. Дифференциация 86, 13–22. DOI: 10.1016 / j.diff.2013.06.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роуленд, Л.А., Бал, Н. К., Периасами, М. (2015). Роль термогенных механизмов скелетных мышц в эндотермии позвоночных. Biol. Преподобный Камб. Филос. Soc. 90, 1279–1297. DOI: 10.1111 / brv.12157
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рубенштейн, А. Б., Смит, Г. Р., Рауэ, У., Бег, Г., Минчев, К., Руф-Замойски, Ф. и др. (2020). Одноклеточные профили транскрипции в скелетных мышцах человека. Sci. Реп. 10: 229.
Google Scholar
Сабателли, П., Гуаланди, Ф., Гара, С. К., Грумати, П., Зампарелли, А., Мартони, Э. и др. (2012). Экспрессия α5 и α6 цепей коллагена VI в мышцах человека и при мышечном фиброзе, связанном с мышечной дистрофией Дюшенна. Matrix Biol. 31, 187–196. DOI: 10.1016 / j.matbio.2011.12.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Санес, Дж. Р. (1982). Ламинин, фибронектин и коллаген в синаптических и внесинаптических частях базальной мембраны мышечных волокон. Дж.Cell Biol. 93, 442–451. DOI: 10.1083 / jcb.93.2.442
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саволайнен, Дж., Вяэнянен, К., Пуранен, Дж., Такала, Т. Е., Комулайнен, Дж., И Вихко, В. (1988). Синтез коллагена и протеолитическая активность в скелетных мышцах крыс: эффект гипсовой иммобилизации в удлиненных и укороченных положениях. Arch. Phys. Med. Rehabil. 69, 964–969.
PubMed Аннотация | Google Scholar
Шенфельд, Б.Дж. (2010). Механизмы гипертрофии мышц и их применение в тренировках с отягощениями. J. Strength Cond. Res. 24, 2857–2872. DOI: 10.1519 / JSC.0b013e3181e840f3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schoenrock, B., Zander, V., Dern, S., Limper, U., Mulder, E., Veraksitš, A., et al. (2018). Постельный режим, противодействие физическим упражнениям и восстанавливающее воздействие на систему мышечного тонуса человека в состоянии покоя. Фронт. Physiol. 9: 810. DOI: 10.3389 / fphys.2018.00810
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schönherr, E., Witsch-Prehm, P., Harrach, B., Robenek, H., Rauterberg, J., and Kresse, H. (1995). Взаимодействие бигликана с коллагеном I типа. J. Biol. Chem. 270, 2776–2783. DOI: 10.1074 / jbc.270.6.2776
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шварц Р. И. (2015). Коллаген I и фибробласты: высокая экспрессия белка требует новой парадигмы посттранскрипционной регуляции с обратной связью. Biochem. Биофиз. Rep. 3, 38–44. DOI: 10.1016 / j.bbrep.2015.07.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сефтон, Э. М., и Кардон, Г. (2019). Связующее развитие мышц, врожденные дефекты и эволюция: важная роль соединительной ткани мышц. Curr. Верхний. Dev. Биол. 132, 137–176. DOI: 10.1016 / bs.ctdb.2018.12.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарафи Б. и Блемкер С.С. (2011). Математическая модель передачи силы от оканчивающихся внутри ячеек мышечных волокон. J. Biomech. 44, 2031–2039. DOI: 10.1016 / j.jbiomech.2011.04.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соренсен, Дж. Р., Скоузен, К., Холланд, А., Уильямс, К., и Хилдал, Р. Д. (2018). Острый внеклеточный матрикс, воспалительная реакция и реакция MAPK на удлинение сокращений в скелетных мышцах пожилого человека. Exp. Геронтол. 106, 28–38.DOI: 10.1016 / j.exger.2018.02.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Street, S. F. (1983). Боковая передача напряжения в миофибриллах лягушки: миофибриллярная сеть и поперечные цитоскелетные связи являются возможными передатчиками. J. Cell. Physiol. 114, 346–364. DOI: 10.1002 / jcp.1041140314
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сумиёси, Х., Лауб, Ф., Йошиока, Х., и Рамирес, Ф. (2001).Эмбриональная экспрессия коллагена типа XIX преходяща и ограничена мышечными клетками. Dev. Дин. 220, 155–162. DOI: 10.1002 / 1097-0177 (2000) 9999: 9999 <:: aid-dvdy1099> 3.0.co; 2-w
CrossRef Полный текст | Google Scholar
Суоминен, Х., Хейккинен, Э. (1975). Активность ферментов в мышечной и соединительной ткани M. Vastus lateralis у мужчин от 33 до 70 лет, которые обычно тренируются и ведут малоподвижный образ жизни. Eur. J. Appl. Physiol. 34, 249–254. DOI: 10.1007 / bf00999938
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Суоминен, Х., Хейккинен, Э. и Паркатти, Т. (1977). Влияние восьминедельной физической подготовки на мышцы и соединительную ткань M. Vastus lateralis у 69-летних мужчин и женщин. J. Gerontol. 32, 33–37. DOI: 10.1093 / geronj / 32.1.33
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Swartz, M. E., Eberhart, J., Pasquale, E. B., and Krull, C.Э. (2001). Взаимодействия EphA4 / эфрин-A5 при миграции клеток-предшественников мышц в передних конечностях птиц. Dev. Camb. Англ. 128, 4669–4680.
PubMed Аннотация | Google Scholar
Такаги Р., Огасавара Р., Цутаки А., Наказато К. и Исии Н. (2016). Региональная адаптация коллагена в скелетных мышцах к повторяющимся сериям напряженных эксцентрических упражнений. Pflugers Arch. 468, 1565–1572. DOI: 10.1007 / s00424-016-1860-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такала, Т.Э. и Виртанен П. (2000). Биохимический состав внеклеточного матрикса мышц: эффект нагрузки. Сканд. J. Med. Sci. Спорт 10, 321–325. DOI: 10.1034 / j.1600-0838.2000.010006321.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такала Т. Е., Мюллюля Р., Салминен А., Анттинен Х. и Вихко В. (1983). Повышенная активность пролил-4-гидроксилазы и галактозилгидроксилизилглюкозилтрансферазы, ферментов биосинтеза коллагена, в скелетных мышцах мышей, тренированных на выносливость. Pflügers Arch. 399, 271–274. DOI: 10.1007 / BF00652751
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Там, К. С., Чаудхури, Р., Хатчисон, А. Т., Самоча-Бонет, Д., и Хайльбронн, Л. К. (2017). Ремоделирование внеклеточного матрикса скелетных мышц после кратковременного переедания у здоровых людей. Метаболизм 67, 26–30. DOI: 10.1016 / j.metabol.2016.10.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Там, К.С., Ковингтон, Дж. Д., Байпей, С., Чукалова, Ю., Бурк, Д., Йоханнсен, Д. Л. и др. (2014). Увеличение веса показывает резкое увеличение ремоделирования внеклеточного матрикса скелетных мышц. J. Clin. Эндокринол. Метаб. 99, 1749–1757. DOI: 10.1210 / jc.2013-4381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Tam, C. S., Power, J. E., Markovic, T. P., Yee, C., Morsch, M., McLennan, S. V., et al. (2015). Влияние питания с высоким содержанием жиров на физическую функцию и внеклеточный матрикс скелетных мышц. Nutr. Диабет 5: e187. DOI: 10.1038 / nutd.2015.39
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Thorsteinsdóttir, S., Deries, M., Cachaço, A. S., and Bajanca, F. (2011). Размер внеклеточного матрикса развития скелетных мышц. Dev. Биол. 354, 191–207. DOI: 10.1016 / j.ydbio.2011.03.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тирни, М. Т., Громова, А., Сесилло, Ф. Б., Сала, Д., Спенле, К., Orend, G., et al. (2016). Автономное ремоделирование внеклеточного матрикса контролирует прогрессивную адаптацию регенеративной способности мышечных стволовых клеток во время развития. Cell Rep. 14, 1940–1952. DOI: 10.1016 / j.celrep.2016.01.072
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэдзуми А., Фукада С., Ямамото Н., Такеда С. и Цучида К. (2010). Мезенхимальные предшественники, отличные от сателлитных клеток, способствуют образованию эктопических жировых клеток в скелетных мышцах. Nat. Cell Biol. 12, 143–152. DOI: 10.1038 / ncb2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Uhlen, M., Oksvold, P., Fagerberg, L., Lundberg, E., Jonasson, K., Forsberg, M., et al. (2010). К основанному на знаниях Атласу белков человека. Nat. Biotechnol. 28, 1248–1250. DOI: 10.1038 / nbt1210-1248
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Урчиуоло, А., Куарта, М., Морбидони, В., Гаттаццо, Ф., Молон С., Грумати П. и др. (2013). Коллаген VI регулирует самообновление сателлитных клеток и регенерацию мышц. Nat. Commun. 4: 1964. DOI: 10.1038 / ncomms2964
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vallecillo-García, P., Orgeur, M., Vom Hofe-Schneider, S., Stumm, J., Kappert, V., Ibrahim, D. M., et al. (2017). Odd skipped-related 1 идентифицирует популяцию эмбриональных фибро-адипогенных предшественников, регулирующих миогенез во время развития конечностей. Nat. Commun. 8: 1218.
Google Scholar
Вирджилио, К. М., Мартин, К. С., Пирс, С. М., и Блемкер, С. С. (2015). Многоуровневые модели скелетных мышц показывают комплексное влияние мышечной дистрофии на механику тканей и восприимчивость к повреждениям. Интерфейс Focus 5: 20140080. DOI: 10.1098 / rsfs.2014.0080
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Visse, R., and Nagase, H. (2003). Матричные металлопротеиназы и тканевые ингибиторы металлопротеиназ: структура, функция и биохимия. Circ. Res. 92, 827–839. DOI: 10.1161 / 01.RES.0000070112.80711.3D
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, D., Eraslan, B., Wieland, T., Hallström, B., Hopf, T., Zolg, D. P., et al. (2019). Атлас обилия протеома и транскриптомов 29 здоровых тканей человека. Мол. Syst. Биол. 15: e8503. DOI: 10.15252 / msb.20188503
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Весснер, Б., Либенштайнер, М., Nachbauer, W., and Csapo, R. (2019). Возрастной ответ внеклеточного матрикса скелетных мышц на упражнения с отягощениями: пилотное исследование. Eur. J. Sport Sci. 19, 354–364. DOI: 10.1080 / 17461391.2018.1526974
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уайт, Дж. П., Риси, Дж. М., Вашингтон, Т. А., Сато, С., Ле, М. Е., Дэвис, Дж. М. и др. (2009). Вызванное перегрузкой ремоделирование внеклеточного матрикса скелетных мышц и рост миофибрилл у мышей, лишенных IL-6. Acta Physiol. 197, 321–332. DOI: 10.1111 / j.1748-1716.2009.02029.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вильшут, К. Дж., Хаагсман, Х. П., и Ролен, Б. А. Дж. (2010). Компоненты внеклеточного матрикса управляют поведением стволовых клеток мышц свиней. Exp. Cell Res. 316, 341–352. DOI: 10.1016 / j.yexcr.2009.10.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wood, L. K., Kayupov, E., Gumucio, J. P., Мендиас, К. Л., Клафлин, Д. Р., Брукс, С. В. (2014). Внутренняя жесткость внеклеточного матрикса в скелетных мышцах мышей увеличивается с возрастом. J. Appl. Physiol. 117, 363–369. DOI: 10.1152 / japplphysiol.00256.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Yucesoy, C.A., Maas, H., Koopman, B.H.F.J.M., Grootenboer, H.J., и Huijing, P.A. (2006). Механизмы, вызывающие влияние положения мышц на проксимально-дистальные различия мышечной силы при передаче внемышечной миофасциальной силы. Med. Англ. Phys. 28, 214–226. DOI: 10.1016 / j.medengphy.2005.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заммит П. С. (2017). Функция миогенных регуляторных факторов Myf5, MyoD, Myogenin и MRF4 в скелетных мышцах, сателлитных клетках и регенеративном миогенезе. Семин. Cell Dev. Биол. 72, 19–32. DOI: 10.1016 / j.semcdb.2017.11.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, К., и Гао, Ю. (2012). Конечно-элементный анализ механики боковой передачи силы в одиночном мышечном волокне. J. Biomech. 45, 2001–2006. DOI: 10.1016 / j.jbiomech.2012.04.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhu, J., Li, Y., Shen, W., Qiao, C., Ambrosio, F., Lavasani, M., et al. (2007). Взаимосвязь между трансформирующим фактором роста-β1, миостатином и декорином: последствия для фиброза скелетных мышц. J. Biol. Chem. 282, 25852–25863.DOI: 10.1074 / jbc.M704146200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zong, H., Bastie, C.C., Xu, J., Fassler, R., Campbell, K.P., Kurland, I.J., et al. (2009). Инсулинорезистентность у мышей с дефицитом бета1-рецептора интегрина, специфичного для поперечно-полосатых мышц. J. Biol. Chem. 284, 4679–4688. DOI: 10.1074 / jbc.M807408200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цюгель, М., Маганарис, К. Н., Вильке, Дж., Юркат-Ротт, К., Klingler, W., Wearing, S.C., et al. (2018). Исследование фасциальных тканей в спортивной медицине: от молекул до адаптации тканей, травм и диагностики: утверждение консенсуса. Br. J. Sports Med. 52: 1497. DOI: 10.1136 / bjsports-2018-099308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Классификация типов волокон скелетных мышц человека | Физиотерапия
Скелетные мышцы человека состоят из разнородного набора типов мышечных волокон. 1–3 Этот диапазон типов мышечных волокон обеспечивает широкий спектр возможностей, которые демонстрируют мышцы человека. Кроме того, мышечные волокна могут адаптироваться к изменяющимся требованиям, изменяя размер или состав волокон. Эта пластичность служит физиологической основой для многочисленных физиотерапевтических вмешательств, направленных на увеличение силы или выносливости пациента. Изменения в составе волокон также могут быть частично ответственны за некоторые нарушения и инвалидность, наблюдаемые у пациентов, потерявших физическую форму из-за длительного бездействия, иммобилизации конечностей или денервации мышц. 2 За последние несколько десятилетий количество доступных методов классификации мышечных волокон увеличилось, что привело к появлению нескольких систем классификации. Цель этого обновления — предоставить базовые знания, необходимые для чтения и интерпретации исследований скелетных мышц человека.
Типы мышечных волокон можно описать с помощью гистохимических, биохимических, морфологических или физиологических характеристик; однако классификации мышечных волокон по разным методикам не всегда совпадают. 1 Следовательно, мышечные волокна, которые могут быть сгруппированы с помощью одного метода классификации, могут быть отнесены к разным категориям с использованием другого метода классификации. Для понимания методов классификации мышечных волокон необходимо базовое понимание структуры и физиологии мышц.
Обзор анатомии и физиологии мышечных волокон
Мышечные волокна состоят из функциональных единиц, называемых саркомерами. 3 Внутри каждого саркомера находятся миофибриллярные белки миозин (толстая нить) и актин (тонкая нить).Взаимодействие этих двух миофибриллярных белков позволяет мышцам сокращаться (рис. 1). 4 Несколько методов классификации различают волокна на основе различных структур миозина (изоформ) или физиологических возможностей. 1,2,5 Молекула миозина состоит из 6 полипептидов: 2 тяжелых цепей и 4 легких цепей (2 регуляторных и 2 щелочных). Регуляторная и щелочная легкая цепь связаны с каждой из тяжелых цепей. Тяжелые цепи содержат миозиновые головки, которые взаимодействуют с актином и позволяют мышцам сокращаться (рис.1). 4 Тяжелая цепь миозина в области головы также содержит сайт связывания аденозинтрифосфата (АТФ) и служит ферментом (аденозинтрифосфатаза [АТФаза]) для гидролиза АТФ в аденозиндифосфат (АДФ) и неорганический фосфат (P I ) , который обеспечивает энергию, необходимую для сокращения мышц. Тонкая нить состоит из актина и двух регуляторных белков, тропонина и тропомиозина. 3 Когда мышечное волокно получает стимул в виде потенциала действия, Ca 2+ высвобождается из саркоплазматической сети.Затем кальций связывается с тропонином и через тропомиозин открывает сайт связывания миозина на молекуле актина (рис. 1). 4 В присутствии АТФ головка миозина связывается с актином и тянет тонкую нить вдоль толстой нити, позволяя саркомеру укорачиваться. Пока присутствуют Ca 2+ и АТФ, миозиновые головки будут прикрепляться к молекулам актина, притягивать актин, высвобождать и снова присоединяться. Этот процесс известен как циклическое переключение между мостами. Скорость, с которой может происходить поперечный мостиковый цикл, ограничена в основном скоростью, с которой АТФаза миозиновой головки может гидролизовать АТФ.
Рисунок 1
Регуляторная функция тропонина и тропомиозина. Тропонин — это небольшой глобулярный белок с 3 субъединицами (TnT, TnI, TnC). (A) Состояние покоя: тропомиозин в условиях покоя блокирует активные участки актина, предотвращая связывание актина и миозина. (B) Сокращение: когда тропонин связывается с Ca 2+ , он претерпевает конформационные изменения и вытягивает тропомиозин из блокирующего положения на актиновой нити, позволяя миозиновым головкам образовывать поперечные мостики с актином.От Ploughman SA, Smith DL. Физиология упражнений для здоровья, фитнеса и работоспособности . Бостон, Массачусетс: Аллин и Бэкон; 1997: 433. Авторские права 1997 г. принадлежат Allyn & Bacon. Перепечатано / адаптировано с разрешения.
Рисунок 1
Регуляторная функция тропонина и тропомиозина. Тропонин — это небольшой глобулярный белок с 3 субъединицами (TnT, TnI, TnC). (A) Состояние покоя: тропомиозин в условиях покоя блокирует активные участки актина, предотвращая связывание актина и миозина.(B) Сокращение: когда тропонин связывается с Ca 2+ , он претерпевает конформационные изменения и вытягивает тропомиозин из блокирующего положения на актиновой нити, позволяя миозиновым головкам образовывать поперечные мостики с актином. От Ploughman SA, Smith DL. Физиология упражнений для здоровья, фитнеса и работоспособности . Бостон, Массачусетс: Аллин и Бэкон; 1997: 433. Авторские права 1997 г. принадлежат Allyn & Bacon. Перепечатано / адаптировано с разрешения.
Набор мышечных волокон
Первоначально целые мышцы классифицировались как быстрые или медленные в зависимости от скорости сокращения. 3 Это деление также соответствовало морфологическим различиям: быстрые мышцы выглядели белыми у некоторых видов, особенно птиц, а медленные — красными. Покраснение является результатом большого количества миоглобина и высокого содержания капилляров. 3 Повышенное содержание миоглобина и капилляров в красных мышцах способствует большей окислительной способности красных мышц по сравнению с белыми мышцами. Гистологический анализ показывает, что существует корреляция между активностью миозиновой АТФазы и скоростью укорачивания мышц. 6 Этот гистохимический анализ привел к первоначальному разделению мышечных волокон на тип I (медленный) и тип II (быстрый). В настоящее время типирование мышечных волокон осуществляется тремя различными методами: гистохимическим окрашиванием на миозин-АТФазу, идентификацией изоформ тяжелой цепи миозина и биохимической идентификацией метаболических ферментов.
Окрашивание миозиновой АТФазой
У людей скорость гидролиза миозин-АТФазой быстрых волокон в 2–3 раза выше, чем у медленных. 7 Однако гистохимическое окрашивание миозин-АТФазы, которое широко используется для классификации мышечных волокон, не позволяет оценить скорость гидролиза миозин-АТФазы. 1 Волокна разделяются исключительно на основе интенсивности окрашивания из-за различий в чувствительности pH, а не из-за относительной скорости гидролиза АТФаз. 1 Достижения в технике гистохимического окрашивания, используемой для оценки миозин-АТФазы, привели к 7 признанным типам мышечных волокон человека (рис. 2). 1 Первоначально волокна определялись как типы I, IIA или IIB. 1,5 Совсем недавно были идентифицированы типы IC, IIC, IIAC и IIAB, которые обладают промежуточными характеристиками окрашивания миозиновой АТФазой. Самое медленное волокно, тип IC, имеет характеристики окрашивания, больше похожие на волокна типа I, тогда как самое быстрое волокно, тип IIAC, окрашивает больше, чем тип IIA. Волокна типа IIAB имеют промежуточные характеристики окрашивания между волокнами типа IIA и IIB. Поскольку эти очертания основаны на качественном анализе окрашенных волокон, остается вероятность того, что в будущем будет выявлено больше типов волокон.Таким образом, 7 типов мышечных волокон человека, идентифицированные гистохимическим окрашиванием миозин-АТФазой (от самого медленного до самого быстрого): типы I, IC, IIC, IIAC, IIA, IIAB и IIB (рис. 2). 1,3,5 Эти деления основаны на интенсивности окрашивания при разных уровнях pH, и поэтому любое данное волокно может быть сгруппировано по-разному разными исследователями. Кроме того, не во всех исследованиях используются все 7 типов волокон. Некоторые исследователи относят все мышечные волокна к исходным 3 типам волокон.
Рисунок 2
Сравнение 3 различных классификаций типов волокон скелетных мышц: гистохимическое окрашивание на миозин-аденозинтрифосфатазу (mATPase), идентификация тяжелых цепей миозина и биохимическая идентификация метаболических ферментов.Примечание: у людей MHCIIb теперь более точно обозначается как MHCIIx / d. Знаки вопроса указывают на плохую корреляцию между схемами классификации биохимических и тяжелых цепей миозина или мАТФазных волокон.
Рисунок 2
Сравнение 3 различных классификаций типов волокон скелетных мышц: гистохимическое окрашивание на аденозинтрифосфатазу миозина (mATPase), идентификация тяжелых цепей миозина и биохимическая идентификация метаболических ферментов. Примечание: у людей MHCIIb теперь более точно обозначается как MHCIIx / d.Знаки вопроса указывают на плохую корреляцию между схемами классификации биохимических и тяжелых цепей миозина или мАТФазных волокон.
Идентификация тяжелой цепи миозина
Идентификация различных изоформ тяжелой цепи миозина также позволяет классифицировать волокна по типу (рис. 2). 1 Различные волокна на основе миозин-АТФазы соответствуют различным изоформам тяжелой цепи миозина. 1,8 Это неудивительно, потому что тяжелые цепи миозина содержат сайт, который служит АТФазой.Тот факт, что каждое мышечное волокно может содержать более одной изоформы тяжелой цепи миозина, объясняет существование типов волокон миозин-АТФазы, отличных от чистых волокон типа I, типа IIA и типа IIB. Хотя геном человека содержит по крайней мере 10 генов тяжелых цепей миозина, только 3 из них экспрессируются в мышцах конечностей взрослого человека. 1 Изоформы тяжелой цепи миозина могут быть идентифицированы с помощью иммуногистохимического анализа с использованием антител к антимиозину или с помощью электрофоретического разделения додецилсульфат натрия и полиакриламидного геля (SDS-PAGE). 5
Три изоформы миозина, которые были первоначально идентифицированы, были MHCI, MHCIIa и MHCIIb, и они соответствовали изоформам, идентифицированным при окрашивании миозин-АТФазой как типы I, IIA и IIB, соответственно. 1,3,5 Смешанные волокна человека почти всегда содержат изоформы тяжелой цепи миозина, которые являются «соседями» (т.е. MHCI и MHCIIa или MHCIIa и MHCIIb). 2 Следовательно, волокна гистохимической миозин-АТФазы типа IC, IIC и IIAC коэкспрессируют гены MHCI и MHCIIa в разной степени, тогда как волокна типа IIAB коэкспрессируют гены MHCIIa и MHCIIb. 1 Из-за своей количественной природы идентификация изоформ тяжелой цепи миозина с помощью электрофоретического разделения отдельных волокон (метод SDS-PAGE), вероятно, представляет собой лучший метод типирования мышечных волокон. Электрофоретическое разделение позволяет определять относительные концентрации различных изоформ тяжелой цепи миозина в смешанном волокне. 5,8
Один момент, касающийся изоформ тяжелой цепи миозина человека и идентификации типа волокна, может сбить с толку человека, пытающегося читать исследовательскую литературу в этой области.У мелких млекопитающих присутствует четвертая изоформа тяжелой цепи миозина, MHCIIx или MHCIId, которая имеет промежуточную скорость сокращения между изоформой MHCIIa и MHCIIb. 9 Основываясь на нескольких типах доказательств, вплоть до уровня анализа ДНК, то, что было первоначально идентифицировано у людей как MHCIIb, фактически гомологично MHCIIx / d мелких млекопитающих. 2,5,9 В результате то, что у людей называется MHCIIb, на самом деле является MHCIIx / d, и люди не экспрессируют самую быструю изоформу тяжелой цепи миозина (MHCIIb). 5 Поскольку номенклатура типов волокон гистохимической миозин-АТФазы была разработана с использованием мышц человека, волокна типа IIB, которые, как мы теперь знаем, соответствуют изоформе тяжелой цепи миозина MHCIIx / d, вряд ли будут переименованы в тип IIX. 1 Следовательно, в зависимости от автора, человеческие волокна типа IIB на основе гистохимической миозин-АТФазы могут быть связаны либо с изоформами MHCIIb, либо с MHCIIx / d. Важно помнить, что в мышцах конечностей человека присутствуют только 3 изоформы тяжелой цепи миозина (от самой медленной до самой быстрой): MHCI, MHCIIa и MHCIIx / d (ранее ошибочно определялись как MHCIIb). 1 Люди не экспрессируют самую быструю изоформу тяжелой цепи миозина, MHCIIb. 9 В оставшейся части статьи мы будем ассоциировать MHCIIx / d у людей с гистохимическим волокном типа IIB на основе миозин-АТФазы.
Биохимический
Третья схема классификации, которая часто используется для классификации мышечных волокон, объединяет информацию о гистохимии миозин-АТФазы мышечных волокон и качественной гистохимии определенных ферментов, которые отражают энергетический метаболизм волокна (рис.2). 2 Гистохимическое типирование миозиновых АТФазных волокон используется для классификации мышечных волокон как типа I или типа II, которые, как известно, соответствуют медленным и быстрым мышечным волокнам, соответственно. 2 Анализируемые ферменты отражают метаболические пути, которые являются аэробными / окислительными или анаэробными / гликолитическими. 5 Этот метод классификации приводит к 3 типам волокон: быстро сокращающимся гликолитическим (FG), быстро сокращающимся окислительным (FOG) и медленно сокращающимся окислительным (SO). 2,3 Хотя существует хорошая корреляция между волокнами типа I и SO, корреляции между волокнами типа IIA и FOG и волокон типа IIB и FG более разнообразны. 3,10 Следовательно, волокна типа IIB не всегда зависят в первую очередь от анаэробного / гликолитического метаболизма, а волокна типа IIA не всегда зависят в первую очередь от аэробного / окислительного метаболизма. 5 Хотя, как правило, волокна на конце континуума I типа зависят от аэробного / окислительного энергетического метаболизма, а волокна на конце континуума типа IIB зависят от анаэробного / гликолитического метаболизма, корреляция недостаточно сильна для типа IIB и FG или тип IIA и FOG должны использоваться как взаимозаменяемые. 2,5
Световые цепи миозина
Легкие цепи молекулы миозина также существуют в различных изоформах, медленных и быстрых, которые влияют на сократительные свойства мышечного волокна. 3,11 Мышечные волокна, гомогенные для изоформы тяжелой цепи миозина (т.е. чистые волокна), могут быть гетерогенными в отношении изоформ легкой цепи миозина, хотя в целом быстрых изоформ тяжелой цепи миозина ассоциируются с быстрой изоформ тяжелой цепи миозина. изоформ легкой цепи миозина и медленных изоформ тяжелой цепи миозина связываются с медленными изоформами легкой цепи миозина. 2,5,12 Имеются убедительные доказательства того, что дополнительные белки в мышечных волокнах коэкспрессируются, так что различные «быстрые» белки экспрессируются друг с другом, а различные «медленные» белки экспрессируются друг с другом, что предполагает «волокно». специфическая для типа программа экспрессии генов ». 2,11,12
Классификация моторных агрегатов
Хотя мы обсуждали типы волокон, истинной функциональной единицей нервно-мышечной системы является двигательная единица. 13,14 Двигательная единица — это альфа-мотонейрон (берущий свое начало в спинном мозге) и все мышечные волокна, которые он иннервирует. На основании гистохимии миозин-АТФазы и качественной гистохимии ферментов, которые отражают энергетический метаболизм волокна, все мышечные волокна двигательной единицы имеют схожие характеристики. 15 Двигательные единицы можно разделить на группы в зависимости от сократительной способности и утомляемости мышечных волокон. 3,14 В зависимости от скорости сокращения двигательные единицы классифицируются как медленно сокращающиеся (S) или быстро сокращающиеся (F). 14 Двигатели F подразделяются на быстро сокращающиеся, устойчивые к утомлению (FR), быстро сокращающиеся, средние при утомляемости (Fint) и быстро сокращающиеся утомляющие (FF). 16,17
Моторная единица / пластичность мышечного волокна
Независимо от схемы классификации, используемой для группировки мышечных волокон, есть неопровержимые доказательства того, что мышечные волокна — и, следовательно, двигательные единицы — не только изменяются в размере в ответ на требования, но также могут преобразовываться из одного типа в другой. 2,18,19 Эта пластичность сократительных и метаболических свойств в ответ на стимулы (например, тренировка и реабилитация) позволяет адаптироваться к различным функциональным требованиям. 2 Преобразования волокон между типом IIB и типом IIA являются наиболее распространенными, но преобразования типа I в тип II возможны в случаях тяжелого разрушения или повреждения спинного мозга (SCI). 2,20
Существует меньше доказательств превращения волокон типа II в волокна типа I при тренировках или реабилитации, потому что только исследования, в которых используются денервированные мышцы, которые хронически активируются с помощью электростимуляции, последовательно демонстрируют, что такое преобразование возможно. 21
Изменения типов мышечных волокон также ответственны за некоторую потерю функции, связанную с нарушением кондиционирования. 2 Эксперименты на животных с подвешиванием задних конечностей, которое разряжает мышцы задних конечностей, и наблюдения за людьми и крысами после воздействия микрогравитации во время космического полета продемонстрировали переход от медленных к быстрым типам мышечных волокон. 2 Кроме того, многочисленные исследования животных и людей с ТСМ продемонстрировали переход от медленных к быстрым волокнам. 2,20 Было показано, что у людей ослабление тренированности (то есть уменьшение использования мышц по сравнению с ранее высоким уровнем активности) приводит к такому же медленному превращению в быстрое со сдвигом от MHCIIa к MHCIIx / d и, возможно, от MHCI к MHCIIa. . 2 Также наблюдается снижение уровня ферментов, связанных с аэробно-окислительным метаболизмом. 2 Таким образом, уменьшение использования скелетных мышц может привести к преобразованию типов мышечных волокон в медленном направлении в быстрое.
Интересно, что некоторая потеря работоспособности мышц (например, снижение выработки силы) из-за старения, по-видимому, происходит не только из-за преобразования мышечных волокон из одного типа в другой, но в основном из-за избирательной атрофии определенных групп населения. типов мышечных волокон. 22,23 С возрастом происходит прогрессирующая потеря мышечной массы и максимального потребления кислорода, что приводит к снижению работоспособности мышц и, предположительно, к некоторой потере функции (например, снижению способности выполнять повседневную деятельность), наблюдаемой в пожилые люди. 1,22,23
Потеря мышечной массы, связанная с возрастом, в первую очередь связана с уменьшением общего количества волокон как типа I, так и типа II и, во вторую очередь, из-за преимущественной атрофии волокон типа II. 22,24 Атрофия волокон типа II приводит к увеличению доли мышечной массы медленного типа в старых мышцах, о чем свидетельствует более медленное время сокращения и расслабления в старых мышцах. 25,26 Кроме того, потеря альфа-мотонейронов с возрастом приводит к некоторой реиннервации «покинутых» мышечных волокон соседними двигательными единицами, которые могут быть другого типа. 22,27 Это может способствовать преобразованию типа волокна, поскольку повторно иннервируемые мышечные волокна приобретают свойства новой «родительской» двигательной единицы. 3,22 Недавние данные о старых мышцах предполагают, что может происходить преобразование типа волокон, потому что у пожилых людей наблюдается гораздо большая коэкспрессия тяжелой цепи миозина по сравнению с молодыми людьми. 28 Было обнаружено, что более старые мышцы имеют больший процент волокон, коэкспрессирующих MHCI и MHCIIa (28,5%) по сравнению с более молодыми мышцами (5–10%). 28
К счастью, физиотерапевтические вмешательства могут повлиять на типы мышечных волокон, что приведет к улучшению работы мышц. В контексте этого обновления физиотерапевтические вмешательства можно в общих чертах разделить на те, которые предназначены для повышения устойчивости пациента к утомлению, и те, которые предназначены для увеличения выработки силы пациентом.В течение некоторого времени было известно, что тренировки, которые предъявляют высокие метаболические требования к мышцам (тренировка на выносливость), увеличивают окислительную способность всех типов мышечных волокон, в основном за счет увеличения количества митохондрий, аэробных / окислительных ферментов и капилляризации тренированная мышца. 29,30 Использование системы классификации, основанной на метаболических ферментах, может привести к переходу от FG к FOG мышечным волокнам без, обязательно, конверсии изоформ тяжелой цепи миозина. 2
Состав тяжелых цепей миозина в мышечном волокне может измениться при тренировке на выносливость. 19 Внутри волокон типа II происходит преобразование из IIB в IIA, при этом экспрессируется больше MHCIIa за счет MHCIIx / d. 2,19 Следовательно, процентное содержание чистых волокон типа IIB уменьшается, а процентное содержание волокон типа IIAB и чистого типа IIA увеличивается. Отсутствуют доказательства того, что волокна типа II переходят в тип I при тренировке на выносливость, 19 , хотя, похоже, наблюдается увеличение популяции волокон смешанного типа I и IIA. 2 Исследователи обнаружили, что волокна типа I у людей становятся быстрее при упражнениях на выносливость и медленнее при нарушении кондиционирования. 31,32 Это изменение скорости сокращения происходит не из-за преобразования типов волокон, а скорее из-за изменений изоформ легкой цепи миозина из медленных изоформ в быстрые и из быстрых изоформ в медленные, соответственно. 31,32 Поскольку это изменение скорости мышечного сокращения не происходит за счет изменения миозиновой АТФазы, оно не может быть обнаружено гистохимическим типированием волокон. 2 Переход от медленных к быстрым изоформ легкой цепи миозина позволяет медленным волокнам сокращаться со скоростью, достаточно быстрой для данного упражнения (например, бега, езды на велосипеде), сохраняя при этом эффективные свойства использования энергии. 30 Таким образом, адаптация мышечных волокон к упражнениям на выносливость зависит от типа волокон, хотя окислительная способность всех волокон увеличивается. Волокна типа I могут становиться быстрее за счет преобразования легкой цепи миозина, тогда как волокна типа II превращаются в более медленные, более окислительные типы.
Высокоинтенсивная тренировка с отягощениями (например, тренировка с высокой нагрузкой и малым количеством повторений) приводит к изменениям типа волокон, аналогичным тем, которые наблюдаются при тренировках на выносливость, хотя гипертрофия мышц также играет важную роль в увеличении силы. 33 Первоначальное увеличение выработки силы с помощью программ высокоинтенсивных тренировок с отягощениями в значительной степени опосредовано нервными факторами, а не видимой гипертрофией мышечных волокон у взрослых без патологии или нарушений. 34 Даже в этом случае изменения в мышечных белках, таких как тяжелые цепи миозина, действительно начинаются после нескольких тренировок, но видимая гипертрофия мышечных волокон не проявляется до тех пор, пока тренировка не будет проводиться в течение более длительного периода времени (> 8 недель). 33
Большинство исследователей обнаружили, что высокоинтенсивные тренировки с отягощениями достаточной продолжительности (> 8 недель) вызывают увеличение состава MHCIIa и соответствующее уменьшение состава MHCIIx / d. 35–37 Во многих исследованиях высокоинтенсивных тренировок с отягощениями исследователи также сообщали о сопутствующем увеличении состава MHCI, 37 , хотя некоторые исследователи не сообщают об изменениях в составе MHCI. 38,39 Как тренировки на выносливость, так и тренировки с отягощениями приводят к аналогичному снижению коэкспрессии тяжелых цепей миозина, так что присутствует большее количество «чистых» волокон. 40 Хотя тенденции преобразования типов волокон аналогичны для тренировок на выносливость и силовых тренировок, различия в физиологических изменениях, которые происходят с каждым типом упражнений, также важны. Тренировка на выносливость увеличивает окислительную способность мышц, тогда как тренировка для увеличения выработки силы достаточной интенсивности и продолжительности способствует гипертрофии мышечных волокон за счет увеличения объема сократительных белков в волокнах.
Знание различий между типами волокон скелетных мышц человека позволяет клиницистам более полно понять морфологические и физиологические основы эффективности физиотерапевтических вмешательств, таких как тренировки на выносливость и тренировки с отягощениями.Кроме того, эти знания также предлагают некоторое объяснение изменений в мышцах, которые происходят с возрастом, нарушением условий, иммобилизацией и денервацией мышц. Такие знания полезны для оптимального проектирования реабилитационных программ, направленных на снижение морфологии и физиологии мышц.
Список литературы
1Старон
RS
.Типы волокон скелетных мышц человека: описание, развитие и распределение
.Можно использовать Physiol
.1997
;22
:307
—327
,2Петте
D
,Staron
RS
.Переходные типы волокон скелетных мышц млекопитающих
.Int Rev Cytol
.1997
;170
:143
—223
,3МакКомас
AJ
.Скелетные мышцы: форма и функции
. Шампейн, штат Иллинойс: Human Kinetics,1996
. 4Пахарь
SA
,Смит
DL
.Физиология упражнений для здоровья, фитнеса и работоспособности
.Бостон, Массачусетс
:Allyn & Bacon
,1997
:433
,5Петте
D
,Peuker
H
,Staron
RS
.Влияние биохимических методов на анализ отдельных мышечных волокон
.Acta Physiol Scand
.1999
;166
:261
—277
,6Бараны
м
.АТФазная активность миозина коррелировала со скоростью укорачивания мышц
.Дж. Физиол.
.1967
;50
:197
—218
.7Тейлор
AW
,Эссен
B
,Saltin
B
.Миозин-АТФаза в скелетных мышцах здоровых мужчин
.Acta Physiol Scand
.1974
;91
:568
–570
,8Фрай
AC
,Allemeier
CA
,Staron
RS
.Корреляция между процентом площади типа волокна и содержанием тяжелой цепи миозина в скелетных мышцах человека
.Eur J Appl Physiol Occup Physiol
.1994
;68
:246
—251
,9Хильбер
К
,Galler
S
,Gohlsch
B
,Pette
D
.Кинетические свойства изоформ миозиновой цепи в отдельных волокнах скелетных мышц человека
.FEBS Lett
.1999
;455
:267
—270
.10Хамалайнен
N
,Петле
D
.Паттерны изоформ миозина в волокнах скелетных мышц млекопитающих
.Microsc Res Tech
.1995
;30
:381
—389
.11Талмадж
RJ
,Рой
РР
,Эджертон
ВР
.Типы и функции мышечных волокон
.Curr Opin Rheumatol
.1993
;5
:695
—705
.12Jostarndt-Fogen
К
,Puntschart
A
,Hoppeler
H
,Billeter
R
.Волоконно-специфическая экспрессия быстрых и медленных мРНК незаменимых легких цепей миозина в тренированных скелетных мышцах человека
.Acta Physiol Scand
.1998
;164
:299
—308
,13Берк
РЭ
.Комментарий о наличии моторного блока «Тип
». В кн .: Башня БД, изд.Основные нейронауки
. Нью-Йорк, Нью-Йорк: Raven Press,1975
.Нервная система
.;том 1.
14Берк
РЭ
.Возвращаясь к понятию «тип двигателя
.».Prog Brain Res
.1999
;123
:167
—175
.15Берк
РЭ
,Levine
PN
,Zajac FE
III
.Двигательные единицы млекопитающих: физиолого-гистохимическая корреляция трех типов у кошек gastrocnemius
.Наука
.1971
;174
:709
—712
,16Берк
РЭ
.Типы двигательных единиц трехглавой мышцы бедра кошки
.Дж. Физиол
.1967
;193
:141
—160
,17Sieck
GC
,Prakash
YS
.Морфологические адаптации нервно-мышечных соединений зависят от типа волокна
.Можно использовать Physiol
.1997
;22
:197
—230
,18Гроссман
EJ
,Рой
RR
,Talmadge
RJ
и др. .Влияние неактивности на состав тяжелой цепи миозина и размер волокон камбаловидной мышцы крысы
.Мышечный нерв
.1998
;21
:375
—389
,19Ricoy
JR
,Encinas
AR
,Cabello
A
и др. .Гистохимическое исследование типов мышечных волокон широкой мышцы бедра у спортсменов
.Дж. Physiol Biochem
.1998
;54
:41
—47
.20Рой
руб. ,Talmadge
RJ
,Hodgson
JA
и др. .Дифференциальная реакция быстрых мышц-разгибателей и сгибателей задних конечностей на упражнения у взрослых кошек с спинномозговой системой
.Мышечный нерв
.1999
;22
:230
—241
,21Экен
т
,Гундерсен
К
.Электростимуляция, напоминающая нормальную активность двигательных единиц: воздействие на денервированные быстрые и медленные мышцы крысы
.Дж. Физиол
.1988
;402
:651
—669
,22Ру
MR
,Рис
CL
,Вандервурт
AA
.Возрастные изменения функции моторного блока
.Мышечный нерв
.1997
;20
:679
—690
,23Портер
ММ
,Вандервурт
AA
,Lexell
J
.Старение мышц человека: структура, функции и адаптивность
.Scand J Med Sci Sports
.1995
;5
:129
—142
.24Лекселл
Дж
,Тейлор
CC
,Sjostrom
M
.В чем причина старческой атрофии
? Общее количество, размер и пропорция различных типов волокон, изученных во всей широкой латеральной мышце широкой мышцы бедра, у мужчин в возрасте от 15 до 83 лет.J Neurol Sci
.1988
;84
:275
—294
.25Наричи
МВ
,Бордини
M
,Cerretelli
P
.Влияние старения на функцию приводящей мышцы большого пальца человека
.J Appl Physiol
.1991
;74
:1227
—1281
,26Харридж
SD
,Крайгер
А
,Стенсгаард
А
.Сила, активация и размер разгибателей колена у очень пожилых людей после силовых тренировок
.Мышечный нерв
.1999
;22
:831
—839
,27Камень
г
,Sison
SV
,Du
CC
,Patten
C
.Разрядка моторных единиц у пожилых людей во время сокращений с максимальным усилием
.J Appl Physiol
.1995
;79
:1908
—1913
,28Андерсен
JL
,Terzis
G
,Kryger
A
.Повышение степени коэкспрессии изоформ тяжелой цепи миозина в волокнах скелетных мышц очень старого образца
.Мышечный нерв
.1999
;22
:449
—454
.29Holloszy
JO
,Стенд
FW
.Биохимические адаптации мышц к упражнениям на выносливость
.Анну Рев Физиол
.1976
;38
:273
—291
,30Фитинги
правая
,Видрик
JJ
.Мышечная механика: адаптация с тренировкой
.Exerc Sport Sci Ред.
.1996
;24
:427
—473
,31Ларссон
л
,Li
XP
,Berg
HE
,Frontera
WR
.Влияние отмены функции опоры на сократительную способность и состав изоформ миозина в отдельных клетках скелетных мышц человека
.Арка Пфлюгерс
.1996
;432
:320
—328
.32Видрик
JJ
,Trappe
SW
,Blaser
CA
и др. .Изометрическая сила и максимальная скорость сокращения отдельных мышечных волокон у элитных бегунов-мастеров
.Am J Physiol
.1996
;271
(2 балла 1
):C666
—C675
.33Kraemer
WJ
,Флек
SJ
,Эванс
WJ
.Силовые тренировки: физиологические механизмы адаптации
.Exerc Sport Sci Ред.
.1996
;24
:363
—397
. 34МакАрдл
WD
,Катч
FI
,Катч
VL
.Основы физиологии упражнений
. Филадельфия, Пенсильвания: Леа и Фебигер,, 1994,
. 35Старон
RS
,Карапондо
DL
,Kraemer
WJ
и др. .Адаптация скелетных мышц на ранней стадии тренировок с отягощениями у мужчин и женщин
.J Appl Physiol
.1994
;76
:1247
—1255
,36Kraemer
WJ
,Patton
JF
,Gordon
SE
и др. .Совместимость высокоинтенсивных силовых тренировок и тренировок на выносливость с гормональной адаптацией и адаптацией скелетных мышц
.J Appl Physiol
.1995
;78
:976
—989
.37Старон
RS
,Малики
ES
,Леонарди
MJ
и др. .Гипертрофия мышц и быстрое преобразование типов волокон у женщин, тренирующихся с отягощениями
.Eur J Appl Physiol Occup Physiol
.1990
;60
:71
—79
,38Адамс
ГР
,Hather
BM
,Baldwin
KM
,Dudley
GA
.Состав тяжелых цепей миозина скелетных мышц и тренировки с отягощениями
.J Appl Physiol
.1993
;74
:911
—915
.39Хаккинен
К
,Ньютон
RU
,Гордон
SE
и др. .Изменения морфологии мышц, электромиографической активности и характеристик производства силы во время прогрессивных силовых тренировок у молодых и пожилых мужчин
.J Gerontol A Biol Sci Med Sci
.1998
;53
:B415
—B423
.40Уильямсон
DL
,Godard
MP
,Porter
DA
и др. .Прогрессивные тренировки с отягощениями снижают коэкспрессию тяжелых цепей миозина в отдельных мышечных волокнах у пожилых мужчин
.J Appl Physiol
.2000
;88
:627
—633
.© 2001 Американская ассоциация физиотерапии
BBC Science & Nature — Человеческое тело и разум
Скелетная мышца: обеспечивает движение, поддерживает осанку, стабилизирует суставы и генерирует теплоГладкая мышца: встречается в стенках полых органов
Сердечная мышца: существует только в вашем сердце
Три типа of muscle
В вашем теле около 650 мышц, и они составляют примерно половину вашего веса.Эти мышцы можно разделить на три группы: скелетные, гладкие и сердечные. Все эти мышцы могут растягиваться и сокращаться, но они выполняют очень разные функции.
Скелетная мышца
Ткань, которую чаще всего называют мышцами, — это скелетные мышцы. Скелетные мышцы покрывают ваш скелет, придавая ему форму. Они прикреплены к вашему скелету прочными упругими сухожилиями или напрямую связаны с грубыми участками кости. Скелетные мышцы находятся под произвольным контролем, что означает, что вы сознательно контролируете то, что они делают.
Практически все движения тела, от ходьбы до кивания головой, вызываются сокращением скелетных мышц. Ваши скелетные мышцы функционируют почти непрерывно, чтобы поддерживать вашу осанку, делая одну крошечную корректировку за другой, чтобы ваше тело оставалось в вертикальном положении. Скелетные мышцы также важны для удержания ваших костей в правильном положении и предотвращения смещения суставов. Некоторые скелетные мышцы лица прикреплены непосредственно к коже. Малейшее сокращение одной из этих мышц меняет выражение вашего лица.
Скелетные мышцы выделяют тепло как побочный продукт мышечной деятельности. Это тепло жизненно важно для поддержания нормальной температуры тела.
Гладкая мышца
Гладкая мышца находится в стенках полых органов, таких как кишечник и желудок. Они работают автоматически, без вашего ведома. Гладкие мышцы участвуют во многих «хозяйственных» функциях тела. Мышечные стенки кишечника сокращаются, чтобы пропустить пищу по телу. Мышцы стенки мочевого пузыря сокращаются, чтобы вывести мочу из организма.Гладкие мышцы матки (или утробы) женщины помогают выталкивать ребенка из тела во время родов. Мышца зрачкового сфинктера в глазу — это гладкая мышца, которая сужает размер вашего зрачка.
Сердечная мышца
Ваше сердце состоит из сердечной мышцы. Этот тип мышц существует только в вашем сердце. В отличие от других типов мышц сердечная мышца никогда не устает. Он работает автоматически и постоянно, без пауз. Сердечная мышца сокращается, чтобы выжать кровь из сердца, и расслабляется, чтобы сердце наполнилось кровью.
Вернуться к началу
Как структура и состав мышц влияют на качество мяса и мяса
Скелетные мышцы состоят из нескольких тканей, таких как мышечные волокна, соединительная и жировая ткани. Этот обзор направлен на описание особенностей этих различных мышечных компонентов и их взаимосвязи с технологическими, пищевыми и сенсорными свойствами мяса / мяса различных видов домашнего скота и рыб. Таким образом, сократительный и метаболический типы, размер и количество мышечных волокон, содержание, состав и распределение соединительной ткани, а также содержание и липидный состав внутримышечного жира играют роль в определении внешнего вида, цвета, нежности мяса / мякоти. , сочность, вкус и технологическая ценность.Интересно, что биохимические и структурные характеристики мышечных волокон, внутримышечной соединительной ткани и внутримышечного жира, по-видимому, играют независимую роль, что предполагает, что свойства этих различных мышечных компонентов могут независимо модулироваться генетикой или факторами окружающей среды для достижения эффективности производства и улучшения качества мяса. / качество мяса.
1. Введение
Мышечная масса животных и видов рыб, используемых для производства продуктов питания для людей, составляет от 35 до 60% их массы тела.Поперечно-полосатые скелетные мышцы, прикрепленные к позвоночнику, участвуют в произвольных движениях и облегчают передвижение и позу. Скелетные мышцы обладают широким разнообразием форм, размеров, анатомического расположения и физиологических функций. Для них характерен сложный вид, потому что помимо мышечных волокон они содержат соединительную, жировую, сосудистую и нервную ткани. Мышечные волокна, внутримышечная соединительная ткань и внутримышечный жир играют ключевую роль в определении качества мяса и рыбы.Что касается мяса и водных продуктов, различные заинтересованные стороны, то есть производители, забойщики, переработчики, дистрибьюторы и потребители, предъявляют различные и конкретные требования к качеству, которые зависят от использования ими продуктов. Качество обычно описывается четырьмя терминами: безопасность (гигиеническое качество), полезность (питательная ценность), удовлетворение (органолептическое качество) и удобство обслуживания (простота использования, способность к переработке и цены). Удовлетворенность определяется качествами, воспринимаемыми потребителями.Они включают цвет, текстуру и сочность, а также вкус, который связан с ароматами, выделяемыми во рту при употреблении продукта. Удовлетворенность также обусловлена технологическими качествами, которые отражают способность продукта к переработке. Чаще всего они связаны со снижением технологического выхода из-за снижения водоудерживающей способности во время хранения в холодильнике (экссудации) и приготовления пищи или из-за повреждений, которые возникают после нарезки ломтиками. Лучшие технологические качества связаны с низкими потерями.Питательные качества зависят в первую очередь от питательной ценности жиров, углеводов и белков, входящих в состав пищи. Считается, что мясо, богатое белками с высоким содержанием незаменимых аминокислот и полиненасыщенных жирных кислот, обладает хорошими питательными качествами. Наконец, гигиенические качества отражают способность продукта безопасно потребляться. Они в первую очередь связаны с бактериальной нагрузкой продукта и наличием в продукте химических остатков, таких как гербициды или пестициды, а также других загрязнителей окружающей среды.Среди перечисленных качеств критическими показателями качества говядины для потребителей являются, прежде всего, нежность, цвет и полезность. Однако основной причиной отказа потребителя от покупки говядины является непостоянство его нежности [1]. Лучшее качество у рыбы — плотное, вязкое мясо с хорошей водоудерживающей способностью [2]. В мясе и рыбном мясе на эти качества влияют многие факторы in vivo, и посмертный (pm), такие как виды, генотипы, факторы питания и окружающей среды, условия убоя и переработка pm.Поскольку эти факторы также влияют на структуру и состав скелетных мышц, их влияние на качество мяса может в значительной степени включать прямую связь между внутримышечными биологическими свойствами и характеристиками качества мяса. Однако между видами такие отношения не всегда ясны. Таким образом, цель данной статьи — дать обзор структуры и состава (мышечные волокна, внутримышечная соединительная ткань и внутримышечный жир) мышц домашнего скота и рыб и их взаимосвязи с различными качествами.Недавние геномные исследования различных видов выращиваемых животных с целью выявления новых биомаркеров качества мяса были ранее рассмотрены [3] и, при необходимости, будут кратко рассмотрены в этой статье.
2. Структура мышц
2.1. Макроскопическая шкала
Скелетная мышца состоит примерно из 90% мышечных волокон и 10% соединительной и жировой тканей. Соединительная ткань в скелетных мышцах делится на эндомизий, окружающий каждое мышечное волокно, перимизий, окружающий пучки мышечных волокон, и эпимизий, окружающий мышцу в целом [4, 5].
Когда куски мяса состоят из уникальной мышцы, эпимизий удаляется. Однако, когда кусок мяса включает несколько мышц, отсутствует только внешний эпимизий (рис. 1). Скелетные мышцы также содержат жировую ткань и, в меньшей степени, сосудистую и нервную ткани. У рыбы съедобная часть, филе, состоит из нескольких мышц (миомеров), которые соединены друг с другом и разделены соединительнотканными оболочками толщиной в несколько миллиметров, известными как миосепты. Миосепты демонстрируют структурную непрерывность от позвоночной оси до кожи.Их роль заключается в передаче сил сокращения волокон от одного миомера к другому, а также к скелету и коже. Эта конкретная структура с чередующимися мышечными и соединительными оболочками называется метамерной организацией. У «круглой» рыбы промышленного размера форма миомеров филе напоминает букву W (рис. 2). Однако эта организация более сложна в поперечном сечении (т. Е. Котлета) (рис. 3). Миосепту можно рассматривать как эпимизию мышц наземных животных.Другие внутримышечные соединительные ткани рыб имеют организацию, аналогичную структуре наземных животных. Уникальной характеристикой мышц рыбы является анатомическое разделение в макроскопическом масштабе трех основных типов мышц: большая белая мышца, поверхностная красная мышца (вдоль кожи) и промежуточная розовая мышца. Эти мышцы присутствуют в каждом миомере (рис. 3). Рыбное филе также содержит внутримышечную жировую ткань, расположенную в миомере между миофибриллами и в перимизии, но в основном в миосептах, разделяющих миомеры.
2.2. Микроскопические весы
Мышечные волокна представляют собой удлиненные, многоядерные и веретенообразные клетки диаметром примерно от 10 до 100 микрометров и длиной от нескольких миллиметров у рыб до нескольких сантиметров у наземных животных. У всех видов размер волокон увеличивается с возрастом животного и является важным параметром послеродового роста мышц. Плазматическая мембрана мышечных волокон известна как сарколемма. Площадь поперечного сечения (ППС) волокон зависит от их метаболического и сократительного типов (см. Раздел 3.1 для типов мышечных волокон). У рыб распределение волокон по размеру варьируется в зависимости от важности гипертрофической (увеличение размера клеток из-за увеличения объема) и гиперплазической стадии роста (увеличение объема мышц из-за увеличения числа клеток). Одновременное присутствие мелких и крупных волокон приводит к так называемой «мозаичной» структуре, типичной для рыб (рис. 4).
Независимо от вида миофибриллы, выстроенные в пучки, занимают почти весь внутриклеточный объем мышечных волокон.Миофибриллы имеют диаметр примерно 1 мкм и мкм и состоят из небольших субъединиц: миофиламентов (рис. 1). Продольные поперечные сечения миофибрилл, наблюдаемые с помощью электронной микроскопии, показывают чередование темных (полосы A) и светлых областей (полосы I). Каждая полоса I разделена на две части линией Z. Повторяющаяся единица, находящаяся между двумя линиями Z, — это саркомер, который является сократительной функциональной единицей миофибриллы (рис. 5). Тонкие миофиламенты в основном состоят из актина, тропонинов T, I и C (которые регулируют сокращение мышц) и тропомиозина, расположенных встык вдоль актиновой нити.Толстые миофиламенты в основном состоят из набора молекул миозина, активность АТФазы которых катализирует распад аденозинтрифосфата (АТФ) на аденозиндифосфат (АДФ) и обеспечивает химическую энергию, необходимую для сокращения мышц. Саркоплазма, то есть цитоплазма мышечных волокон, содержит множество растворимых белков, в том числе ферменты гликолитического пути и миоглобин, который переносит кислород в митохондрии и окрашивает клетки в красный цвет. Он также содержит гранулы гликогена, которые представляют собой первичный локальный запас энергии мышечных клеток, в дополнение к каплям липидов.
3. Биохимический состав мышц
Скелетные мышцы содержат примерно 75% воды, 20% белка, 1–10% жира и 1% гликогена. Биохимические свойства основных мышечных компонентов (то есть миофибрилл, соединительной и жировой ткани) описаны ниже.
3.1. Мышечные волокна
Мышечные волокна обычно характеризуются сократительными и метаболическими свойствами [6, 7]. Сократительные свойства в первую очередь зависят от изоформ тяжелых цепей миозина (MyHC), присутствующих в толстых филаментах.В большинстве зрелых скелетно-поперечно-полосатых мышц млекопитающих экспрессируются четыре типа MyHC: I, IIa, IIx и IIb. Активность АТФазы этих MyHC связана со скоростью сокращения: медленным (тип I) и быстрым (типы IIa, IIx и IIb). Волокна типа I демонстрируют низкую интенсивность сокращения, но устойчивы к усталости. Они преобладают в постуральных и дыхательных мышцах. Для сокращения мышц требуется энергия АТФ, потребности в которой сильно различаются для разных типов мышечных волокон [8].
В мышцах используются два основных пути регенерации АТФ: окислительный (аэробный) путь, посредством которого пируват окисляется митохондриями, и гликолитический (анаэробный) путь, при котором пируват превращается в молочную кислоту в саркоплазме.Относительная важность этих двух путей определяет тип метаболических волокон: окислительные (красные; богатые миоглобином, который является переносчиком кислорода и пигментом, отвечающим за красный цвет), или гликолитические (белые; почти не содержат миоглобина, поскольку потребности в кислороде сильно ограничены). . Обычно окислительные красные волокна имеют меньшую CSA, чем гликолитические белые волокна. Однако разница в размере между типами волокон может варьироваться в зависимости от мышцы и внутри одной и той же мышцы. Например, CSA окислительного волокна больше, чем CSA гликолитического волокна в красной части мышцы semitendinosus у свиней [10].Точно так же в мышце Rectus abdominis крупного рогатого скота окислительная красная клетчатка CSA больше, чем белая гликолитическая клетчатка CSA [11]. Наконец, мышечные волокна — это динамические структуры, которые могут переключаться с одного типа на другой по следующему пути: IIIAIIXIIB [12]. Сводка свойств различных типов волокон в зрелых скелетных мышцах млекопитающих представлена в таблице 1. Несмотря на очевидное присутствие их генов, ни одна из трех изоформ взрослых Fast MyHC не присутствует в зрелых мышцах всех видов млекопитающих.Фактически, IIb MyHC не экспрессируется у овец и лошадей и был обнаружен только в определенных мышцах крупного рогатого скота с сильными различиями между породами [13]. Напротив, сильная экспрессия IIb MyHC наблюдается в скелетных мышцах свиней традиционных пород, отобранных по худобе и высоким показателям роста [14]. Независимо от вида, наиболее важным фактором, определяющим состав мышечных волокон, является тип мышц, вероятно, связанный с их конкретной физиологической функцией. Для данной мышцы состав волокон варьируется в зависимости от вида.Так, мышца свиньи Longissimus содержит примерно 10% волокон типа I, 10% IIA, 25% IIX и 55% IIB, тогда как коровья Longissimus содержит в среднем 30% волокон типа I, 18% IIA и 52% IIX. . На состав мышечных волокон также влияют порода, пол, возраст, физическая активность, температура окружающей среды и методы кормления. Как и у млекопитающих, мышечные волокна птиц можно классифицировать на основе их сократительной и метаболической активности. Однако описаны дополнительные классы, например, многотонные иннервируемые медленные волокна типов IIIa и IIIb, специфичные для мускулов птиц [15].У птиц трудно сопоставить изоформу MyHC с типом волокна из-за одновременного присутствия взрослых и развивающихся типов MyHC в зрелых волокнах. Рыбы также обладают различными типами мышечных волокон, которые характеризуются своими сократительными и метаболическими свойствами. Однако, в отличие от млекопитающих или птиц, у рыб можно наблюдать анатомическое разделение между двумя основными типами волокон. Например, у форели быстрые волокна (аналогичные волокнам IIB млекопитающих) находятся в центре в области поперечного сечения тела, а медленные волокна (аналогичные типу I млекопитающих) находятся на периферии вдоль продольной линии под кожа [16].Помимо этих двух основных типов волокон, у определенных видов или на определенных стадиях развития могут быть обнаружены второстепенные типы, такие как промежуточный тип (например, тип розового волокна, сопоставимый с типом IIA). Два основных типа белого и красного волокна связаны с экспрессией быстрого и медленного MyHC соответственно [17]. Однако может быть трудно систематически сопоставить изоформу MyHC с типом волокна из-за одновременного присутствия нескольких MyHC в одном и том же волокне у рыб, особенно в мелких мышечных волокнах.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| : очень низкий; ++: низкий; +++: средний; ++++: высокий; +++++: очень высокий. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Внутримышечная соединительная ткань
Соединительная ткань, которая окружает мышечные волокна и пучки волокон, представляет собой рыхлую соединительную ткань. Он состоит из клеток и внеклеточного матрикса (ECM), который в основном состоит из сложной сети коллагеновых волокон, обернутых в матрикс протеогликанов (PG) [4, 18, 19]. В этой статье основное внимание уделяется молекулам, которые, как было продемонстрировано или предположительно, играют роль в определении сенсорного качества мяса. Коллагены — это семейство волокнистых белков.Независимо от типа коллагена, основная структурная единица коллагена (тропоколлаген) представляет собой спиральную структуру, состоящую из трех полипептидных цепей, намотанных друг на друга, образуя спираль. Молекулы тропоколлагена стабилизируются межцепочечными связями с образованием фибрилл диаметром 50 нм. Эти фибриллы стабилизированы внутримолекулярными связями (дисульфидные или водородные мостики) или межмолекулярными связями (включая пиридинолин и дезоксипиридинолин), известными как поперечные связи (КС). В скелетных мышцах обнаружены различные типы коллагена.Фибриллярные коллагены I и III являются основными, которые появляются у млекопитающих [19]. У рыб преобладает коллаген I и V типов [20]. Другими основными компонентами соединительной ткани являются PG [21]. PG представляют собой сложные многофункциональные молекулы, которые состоят из основного белка с молекулярной массой от 40 до 350 кДа, связанных ковалентными связями с несколькими десятками гликозаминогликановых цепей (GAG). PG образуют большие комплексы, связываясь с другими PG и волокнистыми белками (такими как коллаген). Они связывают катионы (например,г, натрий, калий и кальций) и воду [22]. Пропорция и степень внутримышечного сшивания коллагена зависят от типа мышц, вида, генотипа, возраста, пола и уровня физических нагрузок [23]. Общее содержание коллагена колеблется от 1 до 15% сухого веса мышц у взрослого крупного рогатого скота [19], тогда как оно колеблется от 1,3 ( Psoas major ) до 3,3% ( Latissimus dorsi ) сухого веса мышц у крупных белых свиней. на стадии товарного убоя [24]. У домашней птицы коллаген равен 0.От 75 до 2% сухого веса мышц [25]. Сообщалось о различном содержании в рыбе в зависимости от вида (количество варьируется от 1 до 10% между сардинами и морями [26]), внутри вида и между передней и задней частями (более богатыми) филе [27]. PG составляют небольшую часть сухой массы мышц (от 0,05% до 0,5% у крупного рогатого скота в зависимости от мышц) [28].
3.3. Внутримышечный жир
У млекопитающих резервный жир расположен в нескольких внешних и внутренних анатомических местах, например, вокруг и внутри мышц для межмышечных и внутримышечных жиров (МВФ).В этой статье мы уделяем основное внимание МВФ, поскольку межмышечный жир обрезается во время разделки и, таким образом, оказывает меньшее влияние на свинину и говядину. У рыбы жир располагается подкожно, в перимизиуме и миосепте, и, главным образом, последние влияют на качество мяса и рассматриваются в этой статье. МВФ в основном состоит из структурных липидов, фосфолипидов и запасных липидов (триглицеридов). Последние в основном (примерно 80%) хранятся в мышечных адипоцитах, находящихся между волокнами и пучками волокон, и небольшая часть (5–20%) хранится в виде липидных капель внутри миофибрилл в цитоплазме (внутриклеточные липиды) [29].Между типами мышц содержание фосфолипидов относительно постоянно (т.е. колеблется от 0,5 до 1% свежих мышц у свиней), тогда как содержание триглицеридов в мышцах сильно варьируется независимо от вида [30, 31]. Содержание IMF сильно зависит от размера и количества внутримышечных адипоцитов. У свиней [32, 33] и крупного рогатого скота [30, 34] индивидуальные вариации содержания IMF в данной мышце между животными с аналогичным генетическим фоном были связаны с вариациями в количестве внутримышечных адипоцитов.Напротив, было продемонстрировано, что различия в содержании IMF в данной мышце между животными одного и того же генетического происхождения, подвергающимися разному потреблению энергии с пищей, связаны с вариациями в размере адипоцитов [33]. У рыб увеличение ширины миосепты, вероятно, связано с увеличением количества и размера адипоцитов [35]. Содержание IMF варьируется в зависимости от анатомического происхождения мышц, возраста, породы, генотипа, рациона и условий выращивания домашнего скота [30, 36–39]. Например, китайские и американские свиньи (напр.g., Meishan и Duroc, соответственно) или европейские местные породы свиней (например, иберийская и баскская) имеют более высокие уровни IMF, чем европейские традиционные генотипы, такие как крупная белая, ландрас или пьетрен [40]. Содержание IMF варьируется от 1 до примерно 6% от массы мускулов свежего Longissimus у обычных генотипов свиней на стадии коммерческого убоя, со значениями до 10% у некоторых пород [38]. У крупного рогатого скота содержание IMF в мышцах Longissimus варьируется от 0,6% у бельгийских голубых до 23.3% у чернокожих японцев при убое в возрасте 24 месяцев [41]. Было продемонстрировано, что у французских пород крупного рогатого скота отбор по мышечной массе был связан со снижением содержания IMF и коллагена. Например, основные мясные породы шаролез, лимузин и блонд д’Аквитан имеют меньше МВФ, чем выносливые породы, такие как Обрак и Салер, все они демонстрируют более низкие уровни МВФ, чем молочные породы [42] или американские или азиатские породы, выращиваемые в тех же условиях. [36, 43]. В рыбе содержание IMF также варьируется между видами от менее 3% у «постных» видов, таких как треска, до более 10% у «жирных» видов, таких как атлантический лосось [37], но также и внутри видов.Например, в мясе лосося содержание жира может варьироваться от 8 до 24% [44].
4. Связь между различными мышечными компонентами
Исследования, основанные на сравнении типов мышц, показывают, что содержание IMF обычно положительно коррелирует с процентным содержанием окислительных волокон и отрицательно — с гликолитическими волокнами [45]. Хотя окислительные волокна, особенно медленные волокна, демонстрируют более высокое содержание внутримиоцеллюлярных липидов, чем быстрые гликолитические волокна [46], и хотя содержание IMF часто было выше в окислительных, чем в гликолитических мышцах свиней (т.е.e., Semispinalis против Longissimus мускулов) [47], многие исследования также указывают на отсутствие строгой связи между общим содержанием IMF и составом мышечных волокон [6]. В крайних случаях содержание IMF может быть в три раза выше в белом гликолитике, чем в красной окислительной части мышцы Semitendinosus у свиньи [34] (рис. 6). Отрицательная корреляция между содержанием IMF и окислительным метаболизмом была также обнаружена в мышце свиньи Longissimus при функциональном геномном подходе [48].Однако положительные генетические и фенотипические корреляции наблюдались между содержанием IMF и CSA мышечных волокон в мышцах свиньи Longissimus [49]. У рыб, у которых белые и красные мышцы анатомически разделены, предполагается, что красные мышцы демонстрируют более высокое содержание жира, чем белые, из-за большего количества жировых клеток в перимизии и большего количества липидных капель в мышечных волокнах. У атлантического лосося была отмечена отрицательная генетическая корреляция (rg = -0,85) между общим количеством волокон и содержанием IMF, что предполагает, что при аналогичном весе отбор на низкий IMF приведет к увеличению количества волокна [50].Кроме того, наблюдалась отрицательная корреляция между содержанием коллагена и IMF (rg = -0,8), что указывает на то, что увеличение IMF вызовет относительное снижение содержания коллагена в мышцах, вероятно, из-за его «растворения» в мышечной ткани [51]. Систематической взаимосвязи между биохимическими характеристиками соединительной ткани и типом мышечных волокон у мясных животных не обнаружено. Напротив, у рыб содержание коллагена в красных мышцах выше, чем в белых [52].
5.Механизмы изменения мускулов и качества мяса и плоти: модуляция мышечными свойствами
После убоя мясо обычно хранят в холодном помещении при 4 ° C в течение от 2 до 30 дней в зависимости от вида, последующих методов обработки и упаковки. Самые длительные сроки хранения используются для говядины (от одной до двух недель для тушек до одного месяца для мясных кусков, хранящихся под вакуумом), чтобы облегчить естественный процесс размягчения (старения). Уменьшение CSA мышечных волокон, наблюдаемое во время охлаждения, является результатом латерального сжатия миофибрилл, амплитуда которого зависит от убойного стресса животных и технологии оглушения (Рисунок 7) [53].Фаза старения характеризуется различными ультраструктурными изменениями и приводит к фрагментации мышечных волокон. Действие различных протеолитических систем приводит к характерным миофибриллярным разрывам по Z-линиям (рис. 7). Митохондрии деформируются, а их мембраны изменяются [18, 54]. В результате деградации костамеров, то есть соединения цитоскелетных белков с сарколеммой, сарколемма отделяется от периферических миофибрилл [55]. Согласно Ouali et al.[54], ферментативный процесс начинается, как только происходит кровотечение, с активацией каспаз, которые ответственны за повреждение клеточных компонентов во время апоптоза. Другие протеолитические системы (например, кальпаин, протеасома и катепсины) вступают во владение, чтобы продолжить деградацию белка в клетках и мышечной ткани [56].
Соединительная ткань также претерпевает морфологические изменения во время выдержки мяса [19, 21], которые выявляются уже в 12 часов вечера у кур [25], но только после 2 недель вечера у крупного рогатого скота [57].Это разложение способствует солюбилизации коллагена во время приготовления, тем самым улучшая нежность приготовленного мяса. Также было высказано предположение о косвенном влиянии PG на нежность приготовленного мяса. Фактически, во время старения снижение устойчивости перимизия связано с уменьшением количества PG наряду с увеличением растворимости коллагена из-за повышенной активности некоторых ферментов. Одна из гипотез состоит в том, что PG могут деградировать (спонтанно или ферментативно) во время созревания и больше не защищать коллаген от ферментативных атак [21].У рыб тендеризация мяса связана с постепенным разрушением эндомизия [58] и отслоением волокон друг от друга из-за разрыва связей с эндомизием и миосептой [59]. Рыбы с мягким мясом демонстрируют большее расщепление эндомизия (коллагена, PG) [60]. В миофибриллах рыб наблюдаются слабые ультраструктурные изменения актомиозинового комплекса, в отличие от мышц крупного рогатого скота [61]. Так, у морского леща ( Sparus aurata ) полосы I и Z разрушаются лишь частично после 12 дней хранения в холодильнике [62].
6. Связь между свойствами мышц и качеством мяса
Среди различных компонентов качества мяса рассматриваются технологические, пищевые и сенсорные параметры. Компонент качества питания в первую очередь определяется химическим составом мышечной ткани при убое, в то время как технологические и сенсорные компоненты являются результатом сложных взаимодействий между химическим составом и метаболическими свойствами мышцы при убое и биохимическими изменениями после полудня, которые приводят к ее превращению в мясо. [56, 63].Структура и мышечный состав, кинетика изменений PM и применяемые дополнительные методы использования и обработки мяса (например, измельчение, приготовление) различаются в зависимости от вида и отруба, что приводит к существенным внутренним различиям в качестве мяса между видами животных и порезы. Следовательно, иерархия между наиболее желательными качественными компонентами варьируется между видами. Яркие примеры включают нежность у крупного рогатого скота, твердость рыбного мяса и способность удерживать воду у свиней и кур.
6.1. Технологическое качество
После убоя, в зависимости от вида и рынка, туши хранят в холодном помещении, а затем разрезают на куски или мускулы. Во время хранения меняется внутренняя структура мышц. Мышечные волокна сжимаются в поперечном направлении, вытесняя внутриклеточную воду во внеклеточные пространства, размер которых увеличивается. Впоследствии эта вода выводится через отрезанные концы мышц [53]. Что касается переработки в приготовленные продукты, технологическое качество связано с водоудерживающей способностью мяса, то есть его способностью удерживать внутреннюю воду.На водоудерживающую способность сильно влияет скорость и степень снижения pm pH. Высокий уровень в сочетании с высокой температурой мышц (например, из-за стресса или интенсивной физической активности непосредственно перед убоем) вызывает денатурацию мышечных белков, снижение водоудерживающей способности и усиление экссудации, а также потерю мяса при варке у свиней и домашней птицы. Значительное снижение pH (например, кислое мясо) снижает чистый электрический заряд белков, что также снижает водоудерживающую способность [64, 65].Измерение pH в течение одного часа после убоя, а затем на следующий день для оценки скорости и степени снижения pH, определение цвета и потери воды при хранении в холодильнике являются основными показателями технологического качества мяса. Состав мышечных волокон влияет на технологическое качество мяса, такое как водоудерживающая способность, которая зависит от эволюции кинетики pH и температуры мышц. Снижение pH PM обычно происходит быстрее в гликолитических мышцах, чем в окислительных [66], хотя эта взаимосвязь не носит систематического характера.Фактически, pH в 45 мин после полудня намного ниже в мышцах свинины Psoas major (27% волокна I), чем в мышце Longissimus (10% волокон I) [6], что можно объяснить более низкой буферной способностью. волокна типа I (таблица 1) или различия в кинетике снижения температуры ПМ в зависимости от анатомического расположения мышц. Кроме того, стимуляция гликолитического метаболизма в мышцах в течение часа после убоя увеличивает скорость снижения pH, что в сочетании с высокой мышечной температурой может привести к денатурации белка и бледному, мягкому и экссудативному (PSE) синдрому в белых мышцах, особенно в свиньи и куры.Напротив, степень падения pH после полудня (предельное значение pH; обычно определяется через 24 часа после полудня) постоянно больше в белых гликолитических мышцах, чем в красных окислительных мышцах из-за более высокого содержания гликогена в мышцах in vivo и во время убоя в быстро сокращающихся белых мышцах. гликолитические волокна. В мышцах крупной белой свиньи Longissimus увеличение скорости и степени снижения pH PM связано с более бледным цветом, большей яркостью и экссудацией [49, 67]. У свиней были идентифицированы два основных гена, которые существенно влияют на кинетику снижения pH PM и водоудерживающую способность.Мутация в гене RYR1 (также известном как ген галотана), который кодирует рецептор рианодина, который является частью канала высвобождения кальция саркоплазматического ретикулума, отвечает за быстрое снижение pH pm и развитие мяса PSE [68] . Другой дефект качества свинины связан с мутацией в гене PRKAG3, который кодирует субъединицу AMP-активируемой протеинкиназы (AMPK) [69]. Эта мутация приводит к очень высокому уровню гликогена в мышцах при убое (+ 70%), особенно в гликолитических мышцах, что в значительной степени отвечает за снижение pH после полудня и «кислое мясо» с низкой водоудерживающей способностью.Интересно, что длинная мышца мутантных свиней PRKAG3 содержит больше окислительных волокон [47] и более низкую буферную способность [70], что способствует низкому предельному pH в дополнение к большему производству лактата из гликогена. Недавнее протеомное исследование крупного рогатого скота выявило некоторые корреляции между метаболическими, антиоксидантными и протеолитическими ферментами со снижением pH. Эти данные позволяют лучше понять биологические механизмы раннего вечера, участвующие в снижении pH [71].
6.2. Пищевая ценность
Мясо и плоть являются важным источником белков, незаменимых аминокислот (АК), незаменимых жирных кислот (ЖК), минералов и витаминов (А, Е и В), которые определяют качество питания.Профиль AA относительно постоянен между мышцами или между видами [72]. Однако мышцы, богатые коллагеном, имеют более низкую питательную ценность из-за высокого содержания глицина, несущественного АК [19]. По сравнению с белыми мышцами красные мышцы имеют большее содержание миоглобина и, таким образом, обеспечивают большее количество гемового железа, которое легко усваивается организмом. Хотя IMF составляет небольшую часть мышечной массы, он участвует в потреблении ЖК человеком, потому что содержание и природа (т.е. профиль) мясных ЖК варьируются в зависимости от вида, анатомического происхождения данной мышцы и диеты животных [30, 73].Диетические стратегии интенсивно изучались и оптимизировались для снижения потребления насыщенных жирных кислот и увеличения цис-мононенасыщенных и полиненасыщенных жирных кислот или других биоактивных липидов в продуктах животного происхождения для потребления человеком [30, 73]. Кроме того, поскольку n-3 жирные кислоты с более чем 20 атомами углерода в основном включены в фосфолипиды, а не в триглицериды, можно обогатить содержание мяса этими полиненасыщенными жирными кислотами без увеличения IMF. Например, что касается биоактивных липидов, особенность мяса жвачных животных заключается в наличии жирных кислот, которые прямо или косвенно являются результатом биогидрирования рубца и которые, как предполагается, являются биоактивными жирными кислотами, такими как руменовая кислота, которая является основным природным изомером конъюгированные линолевые кислоты [30] и, как известно, предотвращают определенные формы рака на животных моделях.Однако во время выдержки после полудня и хранения мяса липиды претерпевают изменения (например, перекисное окисление), важность которого зависит от состава ЖК в мясе. Эти изменения могут ухудшить сенсорные (например, цвет, вкус) и питательные качества мяса [63, 74].
6.3. Сенсорное качество
6.3.1. Цвет и внешний вид
Состав мышечных волокон влияет на цвет мяса через количество и химическое состояние миоглобина. Высокое содержание миоглобина в волокнах типа I и типа IIA приводит к положительной взаимосвязи между долей этих волокон и интенсивностью красного цвета.В глубоких мышцах и мясе, хранящемся под вакуумом, миоглобин находится в восстановленном состоянии и имеет пурпурно-красный цвет. Под воздействием кислорода миоглобин превращается в оксимиоглобин, что придает мясу привлекательный ярко-красный цвет. Во время хранения мяса миоглобин может окисляться до метмиоглобина, который дает коричневый непривлекательный цвет, который негативно воспринимается потребителями [75, 76]. Многие факторы до и после полудня, такие как вид животных, пол, возраст, анатомическое расположение и физиологическая функция мышц, физическая активность, кинетика снижения pH после полудня, скорость охлаждения туши и упаковка мяса, влияют на концентрацию и химическое состояние пигментов и, как следствие, цвет мяса [77].Таким образом, мышцы крупного рогатого скота, овец, лошадей и перелетных птиц (например, гусей, уток), которые содержат большое количество волокон типа I, богатых миоглобином, склонны к образованию метмиоглобина и снижению стабильности окраски. Напротив, высокая доля гликолитических волокон приводит к производству белого мяса, как у кур и свиней. КРС с двумя мускулами (мутация в гене миостатина ) имеет мышцы с высокой долей быстрых гликолитических волокон и, как следствие, бледное мясо [3].
Цвет мяса также зависит от диеты. Например, кормление телят коровьим молоком, не содержащим железа, ограничивает биосинтез миоглобина, в результате чего мясо становится бледным в результате дефицита железа.
У рыб только поверхностная латеральная красная мышца, богатая миоглобином, имеет интенсивный (обычно коричневый) цвет, тогда как белая мышца довольно полупрозрачна. В случае лососевых оранжево-красный цвет мякоти обусловлен присутствием в мышечных волокнах пищевых каротиноидных пигментов, таких как астаксантин.Различия в уровнях липидов могут приводить к вариациям толщины миосепты (то есть признаку «белых полос»), что может быть обнаружено обученной сенсорной панелью у рыб, которые демонстрируют контрастирующую мышечную массу, связанную с различным содержанием липидов [78]. На данном срезе рыбы (поперечном сечении) красные мышцы также можно наблюдать на краю белой мышцы, что составляет примерно 90% мышцы. Восприятие потребителями красной мышцы, которая быстро окисляется после полудня до коричневой, а затем до черной, обычно отрицательно, и эту красную мышцу иногда удаляют для продуктов премиум-класса (например,г., копченое филе). Помимо цвета, количество и распределение мраморности внутри мышечного среза влияют на внешний вид и, таким образом, могут повлиять на принятие мяса и мясных продуктов потребителями (см. Раздел 6.3.3). У рыб еще одним серьезным дефектом внешнего вида мяса (филе) является так называемый дефект «зияющего», который возникает в результате частичного разрушения миосепты или интерфейса волокна / миосепта. Биологическое и / или технологическое происхождение этого дефекта качества остается неясным.
6.3.2. Нежность
Нежность и ее изменчивость являются важнейшими сенсорными характеристиками для потребителей говядины. Мясо говядины имеет гораздо более высокую базовую прочность (определяемую пропорцией, распределением и характером внутримышечной соединительной ткани) и более низкий процесс размягчения PM, чем у свинины или птицы [63]. Таким образом, продолжительность старения после полудня важна для нежности говядины [79]. У свиней и птицы кинетика закисления мускулов в мышцах, которая быстрее, чем у крупного рогатого скота [79], сильно влияет на текстуру (т.е.е. сочность, нежность) и технологические свойства мяса (например, водоудерживающая способность) [63]. У крупного рогатого скота взаимосвязь между характеристиками волокон и нежностью является сложной и варьируется в зависимости от мускулатуры, пола, возраста и породы [80]. Например, у быков болезненность Longissimus thoracis часто связана с уменьшением CSA волокон и повышением окислительного метаболизма, тогда как в мышцах Vastus lateralis и semitendinosus чем выше гликолитическая активность, тем меньше мясо [81].Однако отрицательная корреляция между интенсивностью окислительного метаболизма и болезненностью также наблюдалась в мышцах крупного рогатого скота Longissimus [82]. Используя биомаркеры нежности говядины, Picard et al. [83] продемонстрировали, что у пород, характеризующихся более быстрым гликолитическим метаболизмом, таких как французские мясные породы, самые нежные Longissimus thoracis являются наиболее окислительными. Напротив, у пород, у которых метаболизм мышц более окислительный, таких как абердин-ангусский, самый гликолитический Longissimus thoracis является самым нежным.Это согласуется с тем фактом, что у пород с окислительной мускулатурой, таких как ангусы или молочные породы, ребрышки с низкой интенсивностью красного цвета более нежные. Напротив, среди основных французских пород говядины, которые демонстрируют больше гликолитических мускулов, чем краснее мускулы, тем нежнее мясо [83]. Более высокая доля гликолитических волокон может улучшить нежность определенных мышц за счет ускорения старения после полудня из-за наличия более высокого соотношения кальпаин / кальпастатин (два белка, участвующих в протеолизе) [84] в мясе видов животных с медленным старением мяса, такие как крупный рогатый скот и овцы [82].Однако по мнению других авторов, улучшение нежности мяса, связанное с увеличением доли волокон типа I, объясняется более высоким белковым обменом и связанной с ним протеолитической активностью в окислительных волокнах [85]. У быков, за исключением стейков из ребер, нежность мяса, по-видимому, связана не с CSA волокон, а с метаболическими свойствами мышечных волокон.
Функциональное геномное исследование свиней выявило негативное влияние обилия быстрых волокон и высокого гликолитического метаболизма на нежность мяса [48].Это исследование также демонстрирует, что снижение экспрессии генов синтеза белка (например, генов антиапоптотических белков теплового шока и гена кальпастатина) и повышение уровня экспрессии генов, участвующих в деградации белка (особенно протеасом), связаны с более низкой силой сдвига ( т.е. улучшенная нежность) в 13:00. Отрицательная связь между средней величиной CSA быстрых гликолитических волокон и болезненностью была продемонстрирована у свиней [86]. Следовательно, стратегия, направленная на увеличение общего количества волокон в сочетании с умеренным CSA волокон и увеличение процента медленно сокращающихся окислительных волокон, может быть многообещающим средством увеличения количества мышц при сохранении сенсорных качеств свинины [6].Напротив, у кур увеличение CSA волокна в мышце Pectoralis связано со снижением содержания гликогена в мышцах, более высоким предельным pH и водоудерживающей способностью, а также улучшенной болезненностью [87]. Однако противоречивые данные по цыплятам также сообщают о негативном влиянии клетчатки CSA на водоудерживающую способность и нежность мяса [88]. У рыб при сравнении видов была обнаружена отрицательная корреляция между средним диаметром мышечных волокон и плотностью мяса. Однако эта взаимосвязь кажется более противоречивой внутри видов: аналогичные результаты были получены для копченого атлантического лосося и сырого мяса коричневой и радужной форели, тогда как другие исследования не продемонстрировали взаимосвязи между размером волокон и текстурой мяса лосося или трески.В целом, как и у свиней, похоже, что для качества рыбных продуктов лучше гиперплазический, чем гипертрофический рост мышц.
Соединительная ткань влияет на нежность мяса своим составом и структурой [4], особенно у крупного рогатого скота, при этом коллаген обычно считается основным определяющим фактором силы сдвига. Однако есть существенные различия между сырым и вареным мясом. Сила сдвига сырого мяса тесно связана с содержанием в нем коллагена [21, 89].В приготовленном мясе уровень корреляции между содержанием, термической растворимостью или уровнем сшивания коллагена и силой сдвига мяса неясен и варьируется в зависимости от типа мышц и условий приготовления [90, 91]. Во время нагревания коллагеновые волокна сжимаются и давят на мышечные волокна, величина которых зависит от степени сшивания коллагена и организации эндомизия и перимизия. Уровень взаимодействия между коллагеном и мышечными волокнами модулирует тепловую денатурацию коллагена (т.е.е., его желатинизация) и, как следствие, развитие нежности мяса во время приготовления [89]. Считается, что у свиней и кур коллаген ограниченно влияет на сенсорное качество мяса. Причина в том, что животных забивают на относительно ранней физиологической стадии, на которой внутримышечный коллаген не имеет значительных поперечных сшивок [19].
Помимо состава, структура соединительной ткани, в частности ее организация и размер перимизиевых пучков (которые определяют зернистость мяса, особенно говядины), также играют роль в формировании текстуры мяса [ 92].Согласно Purslow [23], взаимосвязь между зернистостью мяса и текстурой указывает на то, что нежность положительно коррелирует с долей пучков небольшого диаметра (называемых первичными пучками), но этот параметр не позволяет точно предсказать нежность. Эллис-Ури и др. [80] не продемонстрировали существенной связи между зерном мяса и нежностью, оцененной обученной сенсорной группой, усилием сдвига или содержанием коллагена и растворимостью. Кроме того, поперечная сила мышцы увеличивается с увеличением толщины вторичных пучков перимизиума у крупного рогатого скота [93] и свиней [94].Встречаются более крупные связки (например, третичные, четвертичные), но они редко учитываются в исследованиях, посвященных нежности мяса. Таким образом, их влияние на структуру соединительной ткани мышц и нежность мяса остается неясным.
Что касается рыб, сравнения между видами продемонстрировали положительную взаимосвязь между плотностью сырого мяса и содержанием в нем коллагена. Однако внутри видов такой связи не наблюдалось. Что касается влияния сшивки коллагена на твердость сырого мяса, только низкая взаимосвязь (= 0.25) между содержанием гидроксилизилпиридинолина (КЛ) и механической прочностью филе наблюдалась у лосося [95]. Из-за своей низкой термостойкости по сравнению с таковой у млекопитающих коллаген мышечной рыбы не сохраняет свои структурные свойства во время приготовления. Таким образом, текстура вареной мякоти во многом зависит от миофибриллярных белков. Сравнение между видами выявило положительную корреляцию между содержанием мышечного коллагена и нежностью и эластичностью приготовленного мяса [26].Однако ни один из этих результатов не был обнаружен среди видов рыб. Виды рыб с плотной плотью демонстрируют очень плотную сеть коллагеновых волокон в эндомизии, тогда как эта сеть гораздо более рыхлая у видов с менее плотной плотью [96].
6.3.3. Сочность и вкус
У крупного рогатого скота и ягнят повышенная доля волокон типа I связана с улучшением сочности и вкуса мяса [85, 97]. Такое благоприятное влияние на вкус, вероятно, объясняется высоким содержанием фосфолипидов в волокнах типа I, причем фосфолипиды являются основным определяющим фактором вкуса приготовленного мяса [98].Однако высокое содержание полиненасыщенных ЖК в фосфолипидах увеличивает риск появления прогорклого вкуса. У свиней высокий процент быстрых оксидогликолитических волокон ухудшает водоудерживающую способность и сочность мяса [85, 99]. IMF часто считается играющим ключевую роль в определении сенсорных качеств мяса или плоти у разных видов животных, положительно влияя на сочность, вкус и нежность, хотя его влияние на сенсорные характеристики варьируется у разных видов [37]. Принято считать, что очень низкие уровни IMF приводят к получению сухого мяса с плохим вкусом.Однако высокая корреляция между IMF и оценками сенсорного качества, присвоенными обученной группой, может наблюдаться только тогда, когда происходят важные изменения и высокие максимальные уровни IMF (например, у свиней) [100]. Фактически, другие факторы могут модулировать эту взаимосвязь, например, предельный pH мяса свиней или содержание и тип внутримолекулярных CL коллагена у крупного рогатого скота [37]. Например, говядина с аналогичным уровнем IMF (примерно 3,2%), полученная из четырех разных пород (ангус, симменталь, шароле и лимузин), показала похожий вкус, но более сочную у лимузина и более низкую сочность у пород ангус [101].Что касается оценки свежего мяса и мясных продуктов потребителями, влияние МВФ кажется противоречивым. Перед потреблением потребители предпочитают меньше мраморной свинины, тогда как во время потребления мясо с большей мраморной отделкой считается сочнее, нежнее и вкуснее [100, 102, 103]. Хотя жиры являются ключевым фактором в развитии вкуса во время приготовления мяса и сочности мяса, потребители часто сопротивляются мясу с видимым IMF. Таким образом, несколько исследований продемонстрировали, что уровень общей приемлемости свинины увеличивается с содержанием IMF до 2.5–3,5% [102, 104]. Однако другие исследования показывают, что значительное число потребителей предпочитают менее мраморную свинину (от 1 до 1,5% IMF) [100, 105]. Также было отмечено различие между группами потребителей, основанное на предпочтении умеренно или слегка мраморной говядины, связанное со вкусом или питательными ожиданиями, соответственно [106]. Таким образом, оценка взаимосвязи между содержанием IMF и сенсорными характеристиками мяса зависит от диетических привычек и культур потребителей, а также от рассматриваемых продуктов.Например, было продемонстрировано, что нежность, сочность и приемлемость сухого окорока увеличивается с увеличением содержания IMF [107]. Однако обратное наблюдается для вареной ветчины, приемлемость которой снижается с увеличением IMF с 2 до 4% в мышце Semimembranosus [108]. Аналогичным образом, изменение IMF от 2,9 до 10,7% по-разному влияет на приемлемость филе лосося в зависимости от конкретного продукта. Пониженное содержание IMF более благоприятно для запеченного филе, тогда как для копченого филе — наоборот [109].
7. Заключение
Три основных компонента мышц (т.е. мышечные волокна, соединительная ткань и жировая ткань) участвуют в определении различных показателей качества мяса, но в разной степени в зависимости от вида, типа мышц и мяса после убоя. -техники обработки. Относительная независимость между характеристиками этих трех основных компонентов мышц предполагает, что можно независимо управлять этими характеристиками с помощью генетических, пищевых и экологических факторов, чтобы контролировать качество продуктов и, таким образом, лучше соответствовать ожиданиям производителей, переработчиков мяса и потребители.
